2020年4月8日,清华大学生命学院葛亮课题组在《细胞》(Cell)期刊上在线发表题为“蛋白跨膜转运调节非经典蛋白分泌”(A translocation pathway for vesicle-mediated unconventional protein secretion)的研究论文,首次报道了非经典分泌过程中的蛋白跨膜转位机制。
蛋白质的分泌是细胞间信息传递的重要方式。分泌蛋白通常具有N端信号肽序列以指导新生多肽链进入内质网(endoplasmic reticulum,ER)被加工、修饰,之后被运输到高尔基体(Golgi apparatus)经过进一步的加工,最终抵达细胞质膜并被释放到细胞外,这一过程被称为经典分泌途径。近年来的研究发现,许多分泌蛋白不具有典型的信号肽序列,其分泌不依赖于ER-Golgi途径,这类分泌途径被称为非经典分泌(unconventional protein secretion, UPS)途径。直接跨质膜转位(I型)与细胞内囊泡结构介导的分泌(III型)是最主要的两种UPS途径。III型UPS中,蛋白首先进入一个囊泡载体(例如autophagosome, endosome等),然后通过膜泡运输系统被运送到细胞外。由于这类蛋白缺少信号肽,一个需要解决的关键问题就是这类UPS蛋白是如何进入囊泡载体中的。
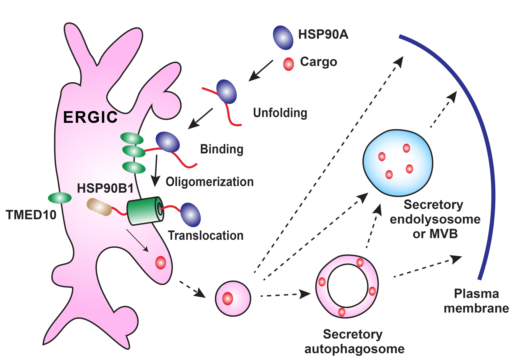
图1. TMED10介导的蛋白质非经典分泌途径工作模型
在这项研究中,研究人员鉴定出一个膜蛋白TMED10可能形成一个蛋白通道介导UPS蛋白进入囊泡结构。细胞实验发现,TMED10能够调控大量非经典分泌蛋白的分泌,包括炎症因子IL-1家族成员,galectin1和galectin3,以及小分子伴侣蛋白HSP5B。CLP诱导的败血性休克(Cecal Ligation and Puncture (CLP)-induced septic shock)小鼠模型中,TMED10髓系敲除的小鼠分泌更少的IL-1b, 进而导致更低的炎症反应与更高的存活率。进一步的研究发现,TMED10的C末端区域与分泌蛋白的一个motif的相互作用对蛋白的选择性转运与分泌非常重要。体外脂质体实验证明,TMED10直接介导UPS蛋白进入脂质体,并且这一过程依赖于蛋白质的去折叠。在细胞中,TMED10定位于ERGIC(ER-Golgi intermediate compartment)并且能够指导分泌蛋白进入这一膜性细胞器中。此外,研究还发现货物蛋白与TMED10的结合会诱导TMED10寡聚化形成蛋白通道从而介导蛋白的转位。基于这些实验数据与之前的研究成果(Zhang et al., 2015),作者提出如图所示的TMED10介导的蛋白质非经典分泌途径(TMED10-channeled UPS , THU)工作模型(图1)。UPS蛋白在胞质分子伴侣HSP90A的帮助下去折叠并被运送到ERGIC,结合TMED10诱导其发生寡聚化形成蛋白通道,在腔内分子伴侣HSP90B1的帮助下转位进入ERGIC,之后可能通过ERGIC形成运输小泡,直接运送到细胞质膜或进入分泌型自噬体,或分泌型自噬溶酶体/MVB,分泌型自噬体又可以直接和质膜融合或首先与溶酶体融合,最终将蛋白释放到细胞外。
生命学院葛亮研究员为本文的通讯作者,实验室张敏老师与生命学院博士生刘磊为本文共同第一作者。本研究受到基金委和科技部的经费资助。
文章链接:https://doi.org/10.1016/j.cell.2020.03.031
?