大脑皮层是神经系统的最高级认知功能中心,其结构与功能的复杂性,在很大程度上取决于组成它的神经元数量以及细胞类型多样性。人类大脑皮层有约160亿个神经元,主要分为谷氨酸能兴奋性神经元与γ-氨基丁酸能抑制性神经元两大类。同时,根据形态、连接靶点、电生理特性及基因表达差异,研究人员已在哺乳动物大脑皮层中鉴定出数百种神经元亚型。抑制性神经元如同“大脑的刹车系统”,负责维持神经网络的兴奋-抑制平衡;这一平衡一旦被破坏,会引发癫痫、自闭症等神经系统疾病。在进化过程中,大脑皮层扩张伴随着抑制性神经元数量与比例的同步增加。然而,在人类大脑发育过程中不同类型抑制性神经元是如何有序产生的,以及人脑通过何种机制实现抑制性神经元数量和比例的显著扩增,至今仍是神经科学领域的核心科学问题。
2026年1月15日,清华大学米达团队联合中国医学科学院北京协和医院朱兰院士团队在《科学》(Science) 发表了一项突破性研究“脑室下区放射状胶质细胞维持人脑抑制性神经元的持续产生” (Subventricular zone radial glial cells maintain inhibitory neuron production in the human brain)。该研究聚焦人脑动态发育过程,基于珍贵样本系统绘制了人类大脑内侧神经节隆起(MGE)脑区的细胞发育图谱,首次在人类胎儿大脑中发现了一类独特的神经干细胞类型—— SVZ RGC (脑室下区放射状胶质细胞),并揭示SVZ RGC在人类妊娠期中持续产生抑制性神经元和神经胶质细胞,从而增加了人类大脑皮层抑制性神经元的数量及比例。这项研究为深入理解人类特有的大脑抑制性神经元发育机制和在进化上大脑皮层扩张机制提供了重要理论基础。鉴于抑制性神经元的功能缺陷与癫痫、自闭症等多种神经系统疾病密切相关,这类新型神经干细胞的发现将为未来相关疾病的潜在干预策略开辟新的方向。
研究亮点一:鉴定灵长类独特的神经干细胞类型
哺乳动物大脑皮层抑制性神经元主要起源于腹侧端脑中的内侧神经节隆起(MGE)。研究团队综合应用空间转录组与单细胞转录组测序技术,系统描绘了人类妊娠第9周到第39周MGE脑区的发育景观。该研究首次在人类胎儿MGE脑区中发现一类新型神经干细胞类型(SVZ RGC),其在分子标记、空间分布与分裂行为上均与之前报道过的神经干细胞类型具有明显区别。跨物种比较分析显示,SVZ RGC普遍存在于灵长类大脑中,但在小鼠大脑中未见同源类型。功能验证实验显示,SVZ RGC在人类胎儿期持续产生抑制性神经元和神经胶质细胞,揭示SVZ RGC是人类大脑抑制性神经元数量与比例增多的关键细胞基础。
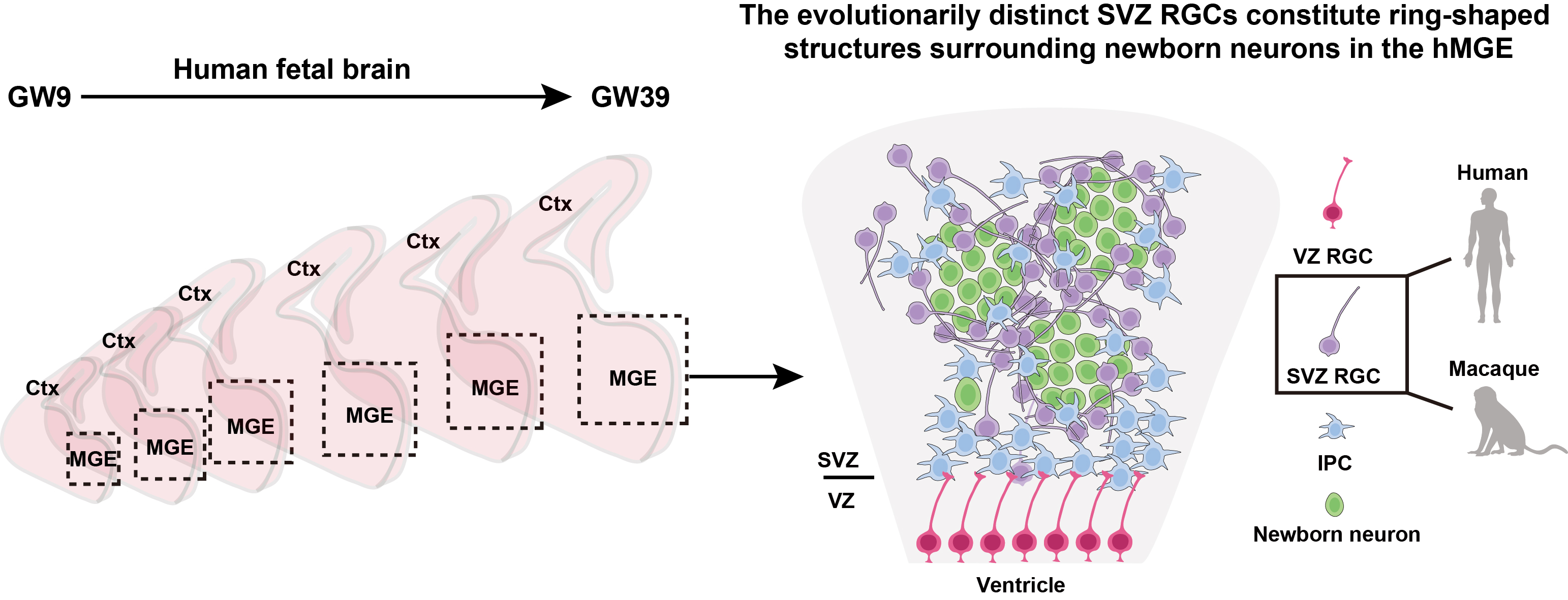
图1. 人类内侧神经节隆起中不同细胞类型的鉴定。图中采用不同的形态与颜色标示各异的细胞类型。
研究亮点二:解析人类大脑抑制性神经元多样性的时空发育机制
人类大脑神经元的惊人多样性是支撑高级脑认知功能的根本基石。人类大脑中数量巨大、种类繁多的神经元是如何由数量和种类都相对有限的神经干细胞有序产生的,是神经科学领域的核心科学问题。本研究系统绘制了人类胎儿MGE脑区的神经发生时空图谱,揭示了人类大脑抑制性神经元多样性产生的核心机制。研究发现人类MGE中存在高度区隔化的神经祖细胞域(progenitor domain),并且该祖细胞域与多种抑制性神经元谱系之间具有明确对应关系。同时,研究揭示人类MGE中的神经发生具有严格的时空规律:发育早期,位于脑室区(VZ)的LHX8/ISL1+和NR2F1/NR2F2+祖细胞域率先进行神经发生;发育后期,位于脑室下区(SVZ)的EPHA5/MEF2C+,CRABP1/ANGPT2+和LHX6/NFIA+祖细胞域成为了主要的神经发生场所。这些结果表明,在人类大脑发育过程中部分抑制性神经元类型的身份早在祖细胞阶段就已建立,并受到其“出生地”和“出生时间”的严格限制。
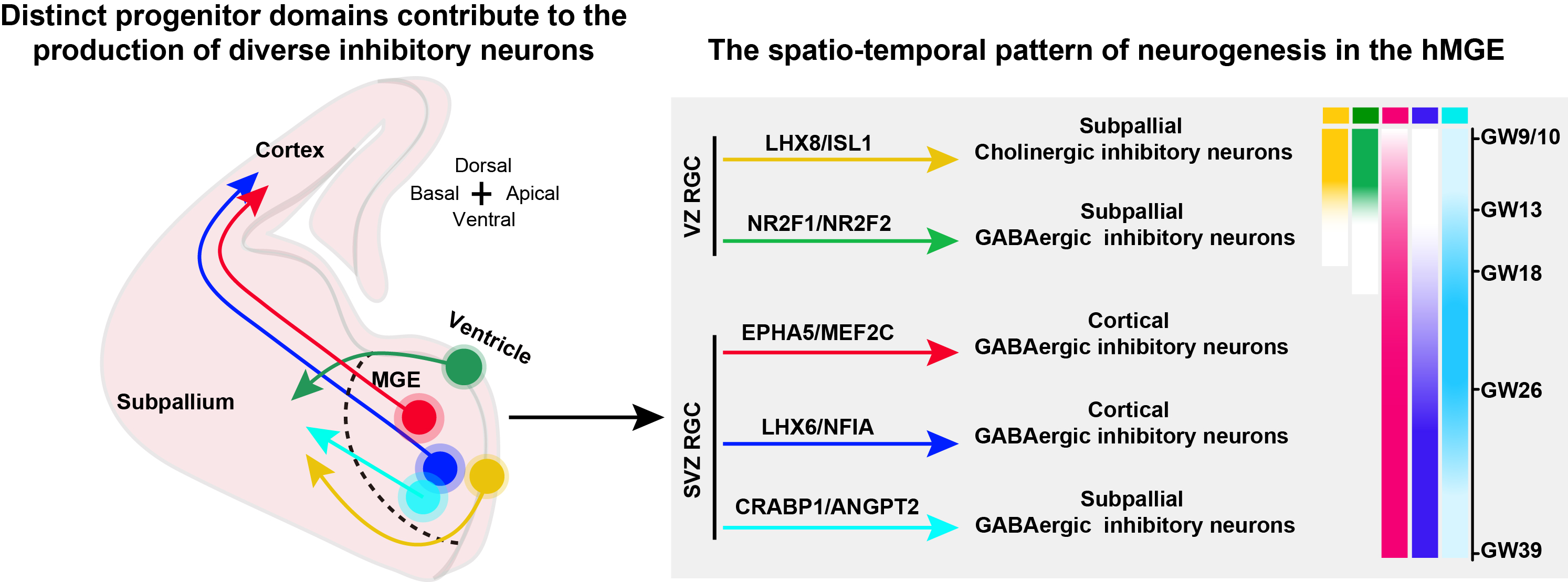
图2. 人类内侧神经节隆起神经发生的时空动态。图中不同颜色的圆圈对应不同的祖细胞域,箭头颜色则标示了由此产生的特定神经元谱系。
研究亮点三:提出“双引擎模型”驱动大脑皮层进化
本研究提出了一个“双引擎模型”,阐释大脑皮层进化逻辑,即人类大脑皮层扩张是由两类进化上独特的神经干细胞类型协同驱动:位于背侧端脑(大脑皮层)中的oRG(外侧放射状胶质细胞)如同“兴奋性神经元工厂”,主导兴奋性神经元的数量扩增;位于腹侧端脑中的SVZ RGC驱动了抑制性神经元数量和比例的增加。二者的协同工作,共同保障了人类大脑兴奋-抑制网络的动态平衡与高级脑认知功能的建立。这项研究揭示,人脑无与伦比的结构和功能复杂性源于进化上特有的发育机制。该发现为深入理解大脑皮层进化规律和相关调控机制提供了重要理论框架。
高质量生物样本的获取,始终是推进人类发育相关研究的关键瓶颈。本研究的顺利实施,得益于北京协和医院朱兰院士团队所构建的标准化人类胎儿生物样本库及配套发育研究平台。这一体系化的研究平台,为包括本项脑发育研究在内的多项前沿探索,提供了不可或缺的样本支撑与研究基础。
清华大学生命科学学院副教授,清华-IDG/麦戈文脑科学研究院、生命科学联合中心、膜生物学全国重点实验室研究员米达与中国医学科学院北京协和医院朱兰院士为该论文的共同通讯作者。清华大学生命科学学院博士后贾陇忠、2019级博士生李晓寒 、2021级博士生燕逸铭、博士后徐林壑以及中国医学科学院北京协和医学院郭建宾博士(已毕业)为论文共同第一作者。清华大学生命科学学院博士后王伟超、李莲燕和2024级博士生张蔚榕为本研究做出了重要贡献。该研究得到中国科学院脑科学与智能技术卓越创新中心黄薇研究员的大力支持。此外,该研究也得到清华大学生命科学学院时松海院士、伦敦大学国王学院Oscar Marín院士的指导。该研究获国家科技创新2030“脑科学与类脑研究”重大专项、国家重点研发计划、国家自然科学基金、清华-IDG/麦戈文脑科学研究院、清华-北大生命科学联合中心、膜生物学国家重点实验室、清华大学“笃实”专项、国家高水平医院临床科研专项、山东省泰山学者专项基金等经费支持。
原文链接:https://doi.org/10.1126/science.adw1803
专家点评1:时松海 (中国科学院院士,清华大学生命科学学院院长)
人类大脑皮层在进化过程中显著扩张,其高级认知功能的实现依赖于两大神经元群体:谷氨酸能兴奋性神经元与γ-氨基丁酸能(GABA能)抑制性神经元。既往研究聚焦于兴奋性神经元的数量扩增与大脑皮层进化的关系,却长期忽视另一更重要的现象:在哺乳动物大脑进化中,抑制性神经元不仅与兴奋性神经元同步扩增,其比例亦显著升高,重塑了人类大脑皮层环路的连接模式,从而为高级脑认知功能奠定细胞基础。然而,人脑如何在发育阶段生成规模如此庞大的抑制性神经元库,始终是未解之谜。
目前,关于大脑皮层进化的研究主要集中于背侧端脑(即大脑皮层本身)原位产生的兴奋性神经元数量扩增机制。已有研究表明,发育期的人类背侧端脑富集一类特殊的神经干细胞——外侧放射状胶质细胞(oRG),其通过延长神经发生过程驱动兴奋性神经元数量的跃升。相较之下,绝大多数大脑皮层抑制性神经元起源于腹侧端脑的内侧神经节隆起(MGE)。由此引出一个关键问题:人类腹侧端脑是否拥有类似oRG的神经干细胞类型,从而驱动大脑皮层抑制性神经元的扩增?
米达团队与朱兰团队的合作研究首次鉴定出人类 MGE脑室下区放射状胶质细胞(SVZ RGC)这一全新神经干细胞类群:其广泛存在于灵长类,而在啮齿类(小鼠)中完全缺失,且具备持续整个妊娠期的抑制性神经元生产能力。这一发现从源头解释了人脑抑制性神经元数量与比例跃升的核心原理。基于此,作者进一步提出“双引擎”进化模型:背侧端脑的 oRG 作为“兴奋性神经元工厂”主导兴奋性神经元数量扩增;腹侧端脑的 SVZ RGC 充当“抑制性神经元生产线”,驱动抑制性神经元数量与比例的同步提升。两类进化上特有的神经干细胞协同运作,共同维持人类大脑皮层兴奋-抑制网络的动态平衡,从而为人类高级认知功能的形成奠定细胞学基础。
这项研究不仅填补了人类大脑抑制性神经元扩增机制的理论空白,更进一步完善了大脑皮层进化的理论框架:人类大脑皮层扩张并非简单放大旧有结构,而是由两类进化上独特的神经干细胞精密协同驱动。
专家点评2:张旭 (中国科学院院士,发展中国家科学院院士,广东省智能科学与技术研究院院长)
抑制性神经元是大脑皮层中除兴奋性神经元外另一关键神经元类型,其通过释放γ-氨基丁酸(GABA)调节兴奋性神经元活动,维持大脑皮层神经网络的兴奋-抑制平衡。抑制性神经元异常与癫痫、孤独症、精神分裂症等多种疾病密切关联。大脑中的抑制性神经元在形态结构、基因表达、环路连接及电生理特性等方面表现出高度多样性。然而,人脑中不同类型抑制性神经元的谱系发育规律——即神经干细胞如何有序分化产生出各类抑制性神经元——目前仍不清楚。因此,大脑皮层抑制性神经元多样性的发育起源是当前神经科学领域亟待解决的重要科学问题之一。
目前邻域内对该问题的理解存在巨大争议:不同类型抑制性神经元的身份是在神经干细胞阶段就已确定,还是在其迁移至大脑皮层后受局部微环境调控而逐步建立?清华大学米达团队与中国医学科学院北京协和医院朱兰团队合作发表于Science的这项研究工作为这一问题的解决提供了重要见解。该研究利用单细胞与空间转录组学技术,系统绘制了人类妊娠 9–39 周内侧神经节隆起(MGE)的高分辨率时空发育图谱,揭示人类大脑抑制性神经元的身份至少在主要类群(major class)层面于神经干细胞(放射状胶质细胞)阶段即已确立。研究还发现,人类MGE中存在分子特征显著不同、空间分布明显区隔化的神经祖细胞域,且这些祖细胞域与不同抑制性神经元谱系间呈现明确对应关系。研究进一步揭示,除空间特化外,不同类型抑制性神经元的产生遵循精确时间顺序。
这项研究系统刻画了人类大脑抑制性神经元产生与多样性形成的核心规律,从发育逻辑上解释了为何人类等高等灵长类大脑具备如此高比例与丰富多样性的抑制性神经元。此外,这项研究也为未来定向诱导特定类型抑制性神经元进行细胞治疗提供了重要理论依据。