哺乳动物卵母细胞的成熟对于配子发生和早期胚胎发育至关重要。哺乳动物卵母细胞成熟伴随着大规模转录活动,但没有DNA复制。顺式调控元件(Cis-regulatory elements, CREs)如启动子和增强子被认为是控制基因表达的核心元件。它们通过招募转录因子与表观调控因子协同调控基因的时空精准表达。在卵母细胞成熟过程中,转录组如何正确地建立并维持,以及CREs如何正常发挥功能一直是领域内长期关注的问题。已有研究显示,小鼠卵母细胞的CREs被H3K27ac和H3K4me3标记【1】,然而CRE的功能调控仍知之甚少。组蛋白变体H2A.Z是组蛋白H2A的高度保守的变体之一,参与基因表达调控和基因组稳定性等生物学过程。不同于复制偶联的经典组蛋白,H2A.Z可以在非复制时进入染色质并替换H2A,从而参与染色质结构的重塑和转录调控。在干细胞、体细胞以及早期胚胎中H2A.Z富集于启动子与增强子,并参与染色质开放、转录因子结合等过程【2-4】。此外,H2A.Z也被发现富集于双效启动子(bivalent promoters),参与调控Polycomb复合物的结合【5】。然而,在卵母细胞发育阶段H2A.Z的功能仍不清楚。
2025年6月13日,清华大学生命学院颉伟研究组联合复旦大学张宇研究组和重庆医科大学向云龙研究组在《自然-结构与分子生物学》杂志(Nature Structural & Molecular Biology)发表了题为“H2A.Z调控卵母细胞成熟与雌性小鼠生育力”(H2A.Z is essential for oocyte maturation and fertility in female mouse)的研究论文。研究首次系统揭示了组蛋白变体H2A.Z在雌性小鼠卵母细胞成熟过程中的核心调控功能,并进一步阐明其在维持顺式调控元件活性、塑造染色质状态及保障雌性小鼠生育力方面的重要机制。
研究人员通过构建小鼠卵母细胞特异性双敲除模型(H2a.z.1与H2a.z.2),发现缺失H2A.Z会导致减数分裂阻滞、染色质凝聚异常及不育表型,提示其对卵母细胞发育至关重要。转录组分析进一步显示,H2A.Z缺失会显著扰乱多个与减数分裂及卵母细胞质量密切相关的基因表达。结合ChIP-seq与组蛋白修饰谱分析,研究者发现H2A.Z及其乙酰化形式(H2A.Zac)广泛存在于活跃启动子和增强子上,而在非活跃高CG含量或Polycomb靶基因的启动子区域则缺失。相比之下,H2A.Z在干细胞和早期胚胎中则在以上区域均有富集。进一步研究发现,H2A.Z缺失会导致部分区域H3K27ac和H3K4me3等活性表观标记的明显下降,尤其是在活性表观标记弱、CG含量低的CRE,提示顺式调控元件功能受损。此外,H2A.Z缺失还造成部分区域H3K27me3修饰的重新分布。这些表观基因组异常与基因表达紊乱相关。
综上所述,本研究首次系统阐明了H2A.Z在哺乳动物卵母细胞中的功能、作用机制,证明是卵母细胞发育成熟的重要表观调控因子。这些研究结果不仅丰富了人们对卵母细胞染色质调控机制的认识,也为探索不育症分子机制、优化辅助生殖策略提供了新的理论基础。
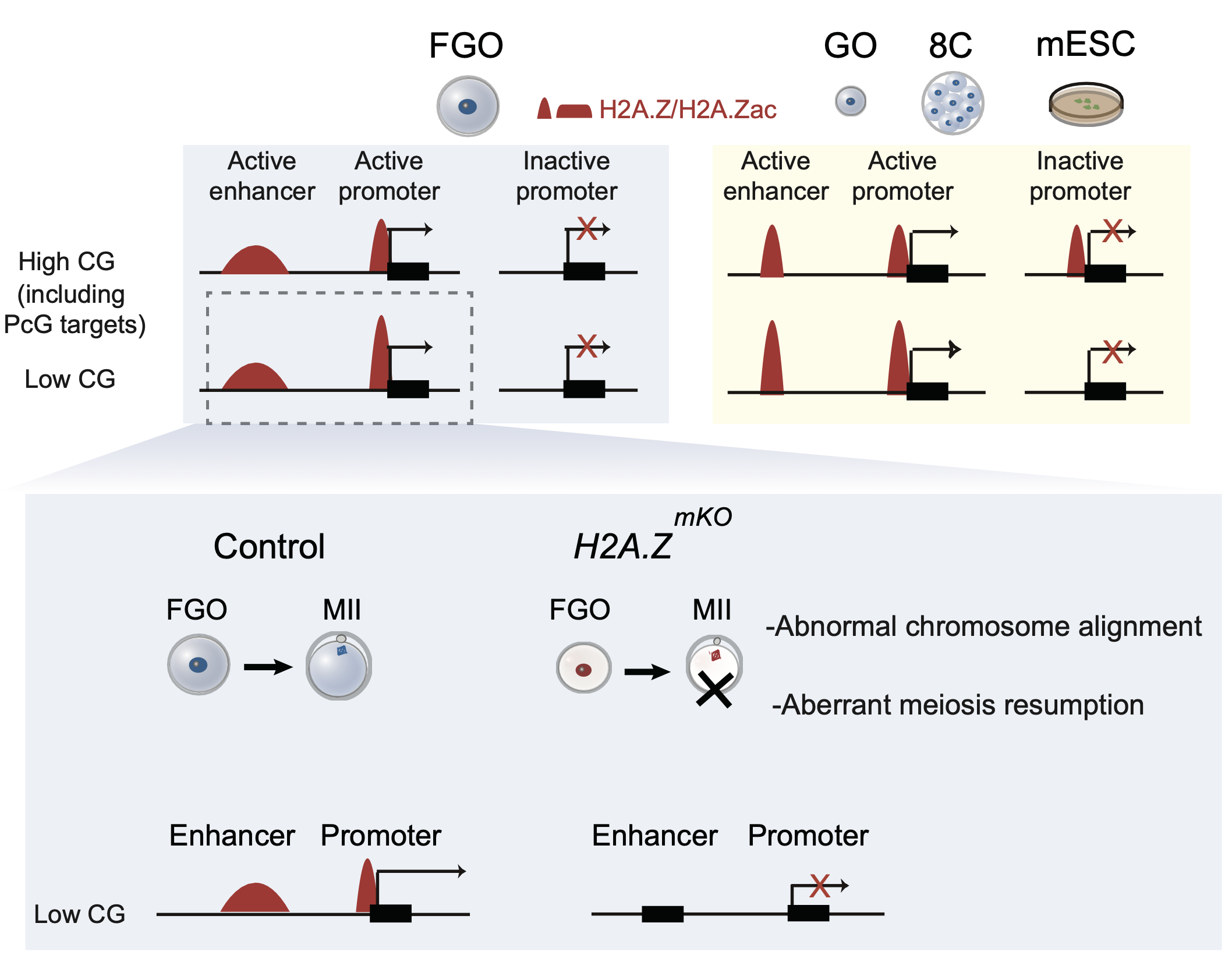
H2A.Z调控卵母细胞成熟功能示意图
清华大学颉伟教授,复旦大学张宇青年研究员和重庆医科大学向云龙教授为本文的通讯作者,清华大学生命学院助理研究员徐倩华和2020级博士生黄春怡为本文共同第一作者。中国科学院生物物理所李国红研究组的陈真博士在该课题中做出了重要贡献。该课题得到了清华大学实验动物中心,生物医学测试中心基因测序平台以及计算平台的大力协助和支持。本研究获得了国家自然科学基金会、国家科技部重点研发计划、清华-北京生命科学中心、新基石基金的经费支持。
论文链接: https://www.nature.com/articles/s41594-025-01580-y
参考文献
1 Liu, B. et al. Mapping putative enhancers in mouse oocytes and early embryos reveals TCF3/12 as key folliculogenesis regulators. Nature cell biology 26, 962-974, doi:10.1038/s41556-024-01422-x (2024).
2 Colino-Sanguino, Y., Clark, S. J. & Valdes-Mora, F. The H2A.Z-nuclesome code in mammals: emerging functions. Trends in genetics : TIG 38, 273-289, doi:10.1016/j.tig.2021.10.003 (2022).
3 Weber, C. M. & Henikoff, S. Histone variants: dynamic punctuation in transcription. Genes & development 28, 672-682, doi:10.1101/gad.238873.114 (2014).
4 Giaimo, B. D., Ferrante, F., Herchenrother, A., Hake, S. B. & Borggrefe, T. The histone variant H2A.Z in gene regulation. Epigenetics & chromatin 12, doi:ARTN 37
10.1186/s13072-019-0274-9 (2019).
5 Wang, Y. et al. Histone variants H2A.Z and H3.3 coordinately regulate PRC2-dependent H3K27me3 deposition and gene expression regulation in mES cells. BMC biology 16, 107, doi:10.1186/s12915-018-0568-6 (2018).