驱动蛋白家族作为微管细胞骨架的分子马达,在细胞内运输中起着重要的作用。与其他ATP酶类似,驱动蛋白的活性在体内需要受到严格的调控。证据显示,驱动蛋白激活机制的失调与神经退行性疾病的发生有关,但细胞究竟如何指挥驱动蛋白“何时何地开工”,至今仍是未解之谜。
北京时间2025年4月24日,清华大学生命科学学院欧光朔教授在《细胞生物学杂志》(Journal of Cell Biology)杂志上发表了题为“磷酸化依赖的纤毛驱动蛋白OSM-3的区域活性调控”( Phosphorylation-dependent regional motility of the ciliary kinesin OSM-3)的研究论文,揭示了NEK家族激酶和PP2A磷酸酶在纤毛驱动蛋白OSM-3区域活性中的调控作用,为理解驱动蛋白活性的时空调控机制提供了全新视角。
欧光朔等实验室的前期研究发现,纤毛组装需要两种运输蛋白接力配合:Kinesin-II负责纤毛中间段的物资运输,此时OSM-3处于失活状态;到达指定位置后,Kinesin-II将任务交接给激活的OSM-3完成远端组装。然而,荧光寿命显微成像提示OSM-3在纤毛基部就已解除自抑制构象,说明存在一种特殊机制使其在开放构象下仍保持失活状态。研究者利用体外生化实验和质谱技术揭示了NEKL-3激酶能够直接磷酸化OSM-3的马达结构域并抑制其ATP酶活性。单分子运动实验和微管滑动实验也证实NEKL-3激酶能显著抑制OSM-3的分子运动活性。与此相反,研究者发现定位于纤毛过渡区和中间段的蛋白磷酸酶PP2A表达量增加会引发OSM-3的提前激活,而PP2A的缺失会导致OSM-3活性降低和纤毛变短。这揭示了磷酸化介导的机制调节纤毛驱动蛋白OSM-3的区域性失活和激活。鉴于分子的保守性,该机制也可适用于其他驱动蛋白区域活性的调控,为分子马达活性的精确时空调控提供了新的见解。
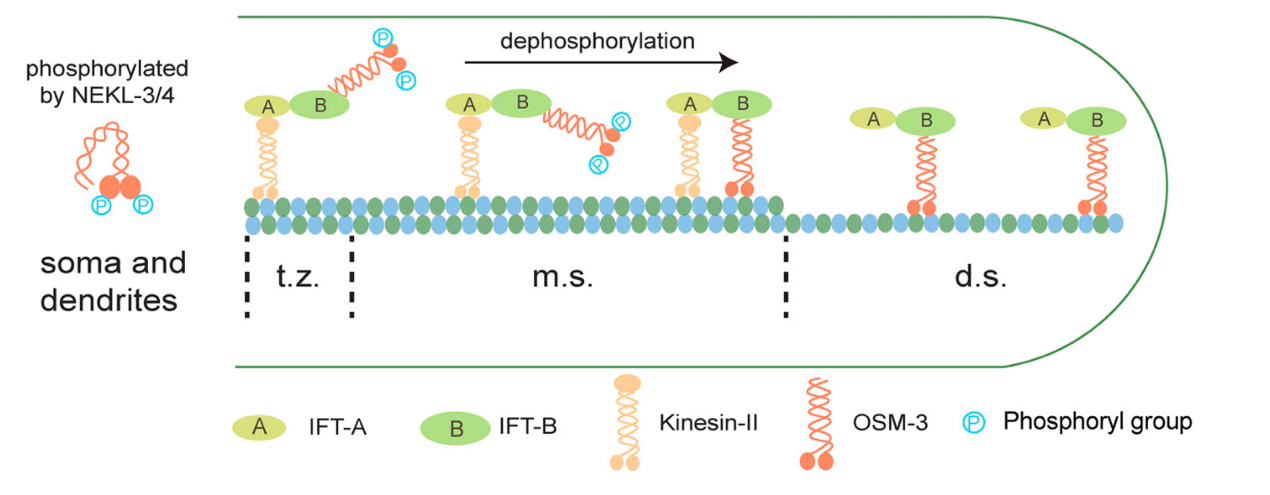
图1. 磷酸化调控纤毛驱动蛋白OSM-3区域活性机制示意图(t.z.:纤毛过渡区;m.s.:纤毛中间段;d.s.:纤毛远端段)。
清华大学生命科学学院欧光朔教授为本文通讯作者;清华大学生命科学学院2021级博士生黄鹏是该文章的第一作者。清华大学生命科学学院2020级博士生陈广涵,2019级博士生陈哲和博士后王时敏也参与了部分工作。该研究工作得到了清华大学冷冻电镜平台的技术支持,以及清华-北大生命科学联合中心、科技部、国家自然科学基金委等相关机构的经费资助。
原文链接:https://doi.org/10.1083/jcb.202407152