复杂的生物过程在细胞、组织的三维空间中时刻维持着精密有序的运转,维系生命活动的基本功能。光片显微镜(LSM)作为当前最适宜进行多细胞、大体积样本三维成像的模态,通过使用两个光轴垂直的物镜分别进行片状激发和宽场探测,提升显微镜光学层切能力的同时显著降低了三维成像时的对活体样本的光漂白和光毒性。但受限于特殊的物镜摆放方式,LSM的空间分辨率往往低于共聚焦显微镜等常规方法,如何提升其分辨率是领域内的一大长期难题。
针对此,诺贝尔化学奖得主Eric Betzig在2014年发明了晶格光片显微镜(LLSM),并通过与结构光照明(SIM)相结合,形成晶格光片结构光照明显微镜(LLS-SIM)解决方案。LLS-SIM可在结构光照明方向上将分辨率提升1.5倍左右,这也是当前最新的前沿技术方法。然而,不同于标准SIM,LLS-SIM仅能产生单一方向的结构光照明,导致空间分辨率各向异性,未超分辨方向易产生畸变,限制了对三维亚细胞动态的精准探测。
近年来,以深度学习为代表的智能计算方法对光学显微镜发展产生变革性影响。通过光学成像系统与智能算法的联合优化,可在极大程度上突破光学系统设计的时空带宽固有局限,实现超高速、超分辨、超长时程活体荧光显微成像。如何基于光学系统与人工智能的交叉创新突破现有观测工具的性能瓶颈,以三维视角和亚细胞级各向同性分辨率观测动态生物过程,是三维超分辨显微成像领域的前沿重要挑战。
2025年4月29日,清华大学生命科学学院李栋课题组与自动化系戴琼海院士团队开展合作,在《自然·方法》(Nature Methods)杂志上发表了题为“快速自适应超分辨晶格光片显微镜助力快速、长时程、近各向同性亚细胞成像”(Fast-adaptive super-resolution lattice light-sheet microscopy for rapid, long-term, near-isotropic subcellular imaging)的研究论文。该研究开发了一种元学习驱动的反射式晶格光片虚拟结构光照明显微镜(Meta-rLLS-VSIM)。结合虚拟结构光照明、镜面增强双视角探测与贝叶斯双视角融合重建等多项技术创新,在不牺牲成像速度与光子代价的前提下,将传统LLS-SIM的一维超分辨能力扩展到XYZ三个维度,实现横向 120 nm、轴向 160 nm 的近各向同性成像分辨率。并进一步将元学习策略与系统数据采集过程深度融合,仅需3分钟就可以完成从训练数据采集到深度学习模型的自适应部署过程,让AI工具在实际生物实验中的应用达到近乎“零门槛”。
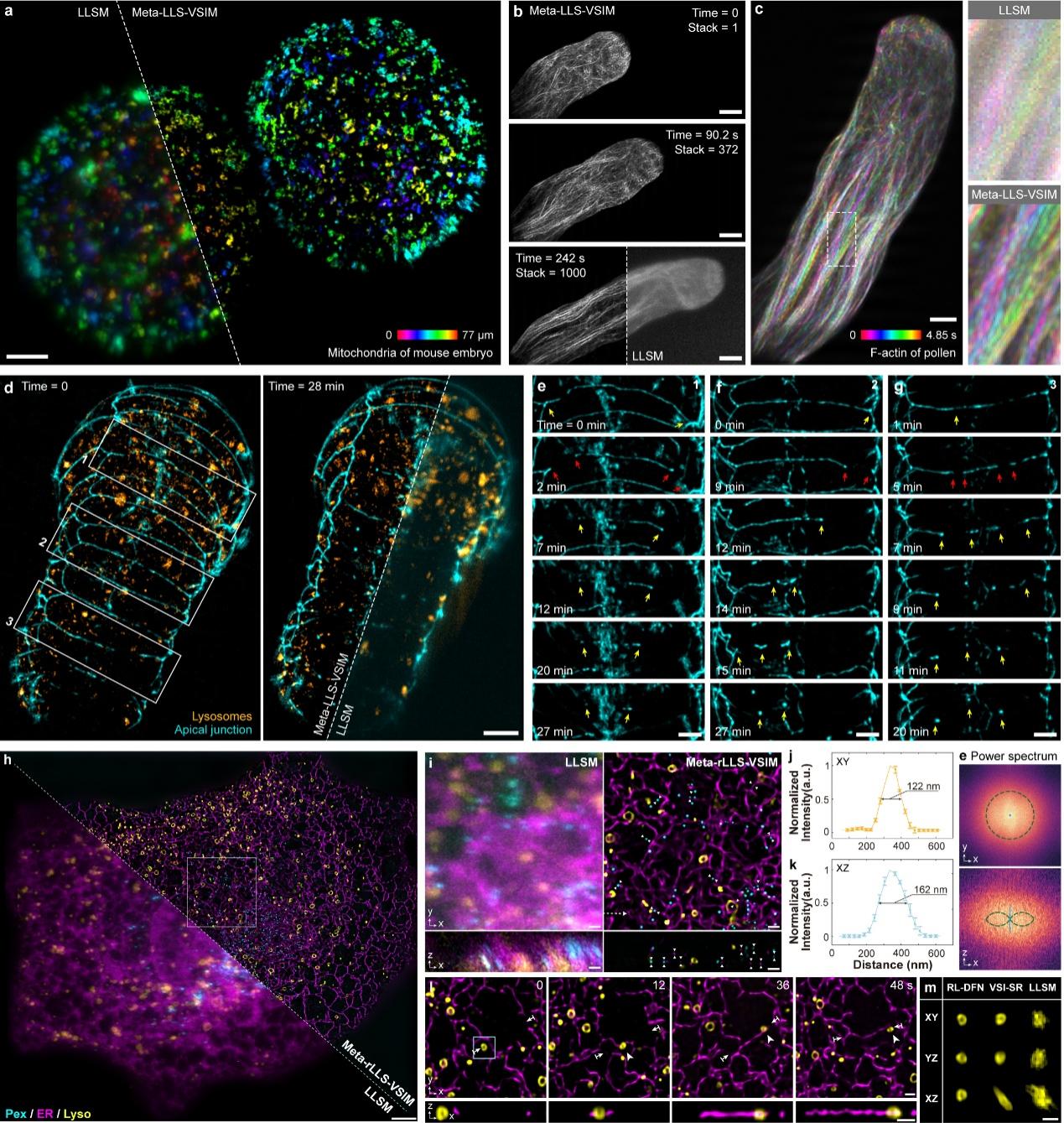
图 Meta-rLLS-VSIM实现快速五维超分辨活细胞成像效果展示
为展示Meta-rLLS-VSIM的快速五维(波长通道-XYZ三维空间-时间)超分辨活细胞成像能力,合作团队对小鼠胚胎(图a)、植物花粉管(图b、c)、线虫胚胎(图d-g)等大体积厚样本进行了长时程超分辨观测。兼具晶格光片照明的物理光学层析与近各向同性的三维超分辨能力,Meta-rLLS-VSIM清晰地揭示了花粉管顶端极性生长、秀丽隐杆线虫胚胎发育过程中质膜融合等生物过程。
进一步地,合作团队利用Meta-rLLS-VSIM对完整COS-7细胞进行了快速(每8秒拍摄一组三通道完整细胞数据)、长时程(>800个时间点)、近各向同性超分辨成像(图h-m),对不同细胞器在三维空间中的分布模式及其与细胞骨架的时空协同互作机制进行了精确的定量研究。得益于高时空分辨率与长周期的观测窗口,合作团队观测到微管与溶酶体之间“搭便车”、线粒体在溶酶体运动产生的机械力作用下分裂等新现象,验证了Meta-rLLS-VSIM发现新生物现象与机制的潜力。
综上,Meta-rLLS-VSIM通过反射增强双视角晶格光片显微镜与元学习驱动的快速自适应部署模式的硬件升级,以及虚拟结构光照明和RL双循环融合网络的人工智能算法创新,实现了软硬件协同优化,显著提升了成像性能。该技术的突破为细胞生物学、神经科学等基础学科的发展提供了新的技术路径,未来有望帮助生命科学研究人员从更全面的多维视角发现、理解和探索丰富多彩的生物现象。
清华大学生命科学院李栋教授、自动化系戴琼海院士为该论文共同通讯作者,清华大学自动化系博士后乔畅、复旦大学副研究员李子薇、中科院生物物理所博士后王宗发、博士生林煜桓、瑞士洛桑联邦理工学院博士后刘冲为该论文共同第一作者。本研究获科技部、国家自然科学基金委员会、以及新基石科学基金会资助。
原文链接:https://www.nature.com/articles/s41592-025-02678-3