弥漫内生型脑桥胶质瘤(Diffuse Intrinsic Pontine Glioma,DIPG)是一种高度致命的儿童脑瘤,被称为“儿童杀手”或“死亡恶魔”。该病主要发生于6至7岁儿童脑干的脑桥区域,呈弥漫性生长,属于儿童高级别胶质瘤(pHGG)中最具恶性的一种。由于肿瘤位于“手术禁区”,手术切除几乎不可能。尽管已有超过300项药物治疗的临床试验,但目前仅有放疗可暂时缓解症状,生存期延长有限,五年生存率甚至低于1%。因此,攻克DIPG成为全球神经科学与肿瘤学界的重大难题。
2025年4月17日,清华大学生命科学学院郗乔然课题组与首都医科大学附属天坛医院张力伟课题组合作,在《自然·通讯》(Nature Communications) 杂志发表题为 “一种由癌组蛋白驱动的 H3.3K27M/CREB5/ID1 轴维持弥漫内生型脑桥胶质瘤的干性和恶性特征”(An oncohistone-driven H3.3K27M/CREB5/ID1 axis maintains the stemness and malignancy of diffuse intrinsic pontine glioma)的研究论文。该研究系统性阐释了癌组蛋白H3.3K27M通过重塑表观遗传景观激活转录因子CREB5,进而调控ID1表达,从而维持DIPG的干性与恶性,为临床治疗提供了潜在的表观遗传靶点。
这项工作是继两个研究团队此前在 Nature Cancer上报道BMP信号通路在不同亚型的DIPG中呈现不同活性后(H3.1K27M亚型BMP信号增强,H3.3K27M亚型BMP信号抑制),进一步深入解析了BMP下游关键靶基因ID1的激活机制。研究表明,尽管在H3.3K27M亚型中BMP信号被抑制,ID1依然高度表达,其表达并非由BMP信号直接驱动,而是由CREB5转录因子通过超级增强子直接激活。这一发现打破了传统“通路—靶基因”线性调控的理解,揭示了癌组蛋白通过CREB5-ID1轴重塑DIPG干性表型的新机制。
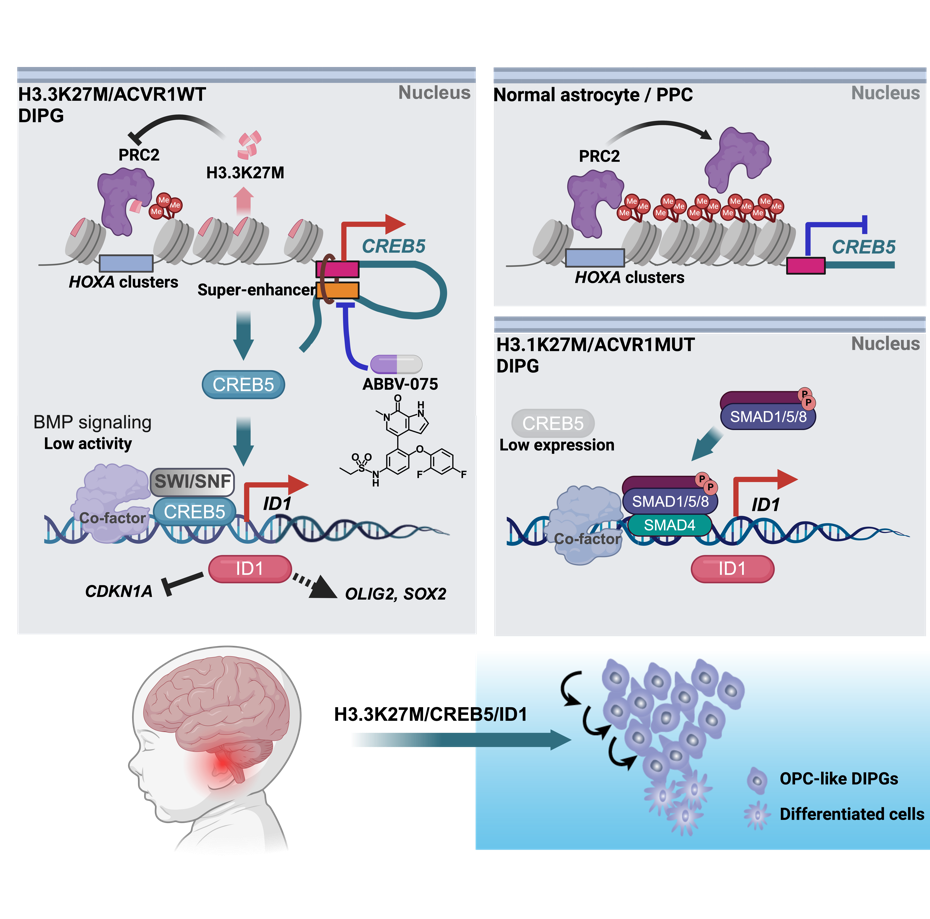
图1. 癌组蛋白在DIPG肿瘤中通过重塑表观遗传景观激活转录调控网络的分子机制
进一步研究显示,CREB5在正常小鼠脑桥中表达极低,受到HOXA基因簇介导的H3K27me3表观遗传沉默,而在H3.3K27M突变的DIPG细胞中,PRC2功能变化导致H3K27me3水平下降,CREB5因而异常激活。CREB5随后与SWI/SNF复合物核心亚基BRG1协同,激活ID1等下游干性因子,维持肿瘤的干性与增殖能力。体内外实验均表明,敲低CREB5显著抑制DIPG细胞的干性特征与成瘤能力,并延长免疫缺陷小鼠生存期。
药物筛选层面,研究团队鉴定出小分子抑制剂ABBV-075可抑制CREB5超级增强子活性,降低CREB5表达、抑制肿瘤生长。联合使用ABBV-075与BRG1抑制剂则产生更显著的协同效果,为表观遗传靶向治疗DIPG提供了新方向。
本研究不仅进一步揭示了癌组蛋白在DIPG中重塑转录网络的分子机制,还延续并深化了团队此前关于BMP通路功能差异性的研究成果,为儿童DIPG基础机制研究和临床转化奠定了坚实基础,带来新的治疗希望。
清华大学生命学院郗乔然副教授、首都医科大学附属天坛医院张力伟教授为本论文共同通讯作者。清华大学生命学院2019级博士生周威与天坛医院医师徐骋为共同第一作者。生命学院2022级本科生杨双瑞与2019级本科生李浩成参与了实验工作。上海交通大学唐玉杰教授提供了部分DIPG细胞系。生命学院米达副教授团队成员李晓寒和乔慧敏提供了发育小鼠脑片,天坛医院泮长存、蒋壮与谢璐阳提供了临床样本与信息支持。
原文链接:https://doi.org/10.1038/s41467-025-58795-2