在大多数真核生物细胞有丝分裂过程中,精确的染色体分离依赖于着丝粒-动粒复合体的正常功能。其中,着丝粒的遗传复制依赖于 CENPA 核小体的传递。具体来说,在细胞周期的G1早期,新生CENPA沉积于染色质中;之后,在发生DNA复制的S期,旧的CENPA被分配于DNA子链和母链上,核小体的空缺由组蛋白H3.3填补。在这一动态过程中,CENPA核小体表现出极高的稳定性,提示细胞中存在严密的CENPA维持机制,而其失调则导致一系列有丝分裂错误和癌症等疾病的产生。但是,对于这一极为关键的分子与细胞过程,在S期内调控CENPA维持以及确保其在DNA复制过程中表观遗传信息忠实传递的机制仍不清楚。
RNA m6A修饰(N6-甲基腺嘌呤)已被广泛报道几乎参与mRNA生命周期的所有阶段,与一系列复杂疾病的发生发展相关。近年来,越来越多的证据表明m6A修饰也存在于非编码RNA,特别是染色质结合的一些RNA(chromatin-associated RNAs,caRNAs)上,并介导新的功能,例如调控染色质状态和基因转录等。此前研究也发现着丝粒区域可以转录出着丝粒重复序列RNA (centromeric RNA, cenRNA),这些cenRNA似乎参与调控着丝粒稳态和细胞周期进程,但其关键机制仍不明确。
2024年9月20日,北京大学生命科学学院、北大-清华生命科学联合中心、北京大学核糖核酸北京研究中心刘君课题组与清华大学生命科学学院杨雪瑞课题组合作,在《细胞》(Cell)发表了题为“肿瘤细胞中cenRNA的甲基化修饰稳定CNEPA蛋白结合从而保证着丝粒完整性”(m6A-modified cenRNA stabilizes CENPA to ensure centromere integrity in cancer cells)的研究论文。该研究首次揭示,肿瘤细胞中的cenRNA存在高频的m6A修饰,而经典的着丝粒特异性组蛋白CENPA可作为着丝粒区域m6A修饰的“阅读器”,特异性结合具有m6A修饰的cenRNA。与甲基化cenRNA的这一互作对稳定CENPA在S期着丝粒区域的维持至关重要,保证了着丝粒区域和基因组的稳定性及染色体的正确分离。对这一互作关系的破坏极大增强了肿瘤细胞对着丝粒相关药物的敏感性,为未来的靶向治疗策略提供了新的思路。
具体来说,研究团队通过整合分析不同细胞类型caRNA的m6A修饰高通量测序(MeRIP-seq)数据集,发现cenRNA在大多数癌细胞中展现出显著升高的m6A修饰水平。为了进一步探究cenRNA m6A修饰的功能, 研究者使用了靶向去甲基化工具CRISPR-dCas13b-FTO系统。特异性擦除cenRNA上的m6A修饰导致了着丝粒丢失、异位、断裂等异常事件的增加,表明cenRNA m6A修饰参与维持着丝粒区域的稳定性。为了探究cenRNA上的m6A修饰如何调控着丝粒完整性,研究者通过SNAP-tag TMR-STAR实验,发现去除cenRNA上的m6A修饰会导致S期CENPA在着丝粒的维持明显受损,而G1时期CENPA的装载几乎不受影响。
为了探究cenRNA上的m6A修饰介导S期着丝粒区域内CENPA稳定性的机制,研究者通过细胞内CENPA的RIP-seq数据分析及一系列体外实验,证实CENPA更倾向于与m6A修饰的cenRNA结合。通过分子模拟及体外实验,研究者进一步确定了CENPA蛋白中两个关键位点,负责识别甲基化的cenRNA。突变这两个位点后, CENPA对m6A-cenRNA的结合偏好性在细胞内显著下降,同时伴随着CENPA在S期着丝粒稳定性的减弱。
鉴于CENPA对于染色体着丝粒功能中的关键作用,研究者进一步评估了CENPA与甲基化cenRNA的互作对着丝粒稳态及癌症细胞生长的影响。结果显示,去除cenRNA上的m6A修饰或突变CENPA均会导致着丝粒不稳定,染色体分离异常,细胞生长减缓,并使肿瘤细胞对着丝粒相关药物的敏感性增强。值得注意的是,这种现象在正常细胞中并未观察到,进一步支持了靶向CENPA-m6A-cenRNA作为癌症治疗策略的可行性(图1)。
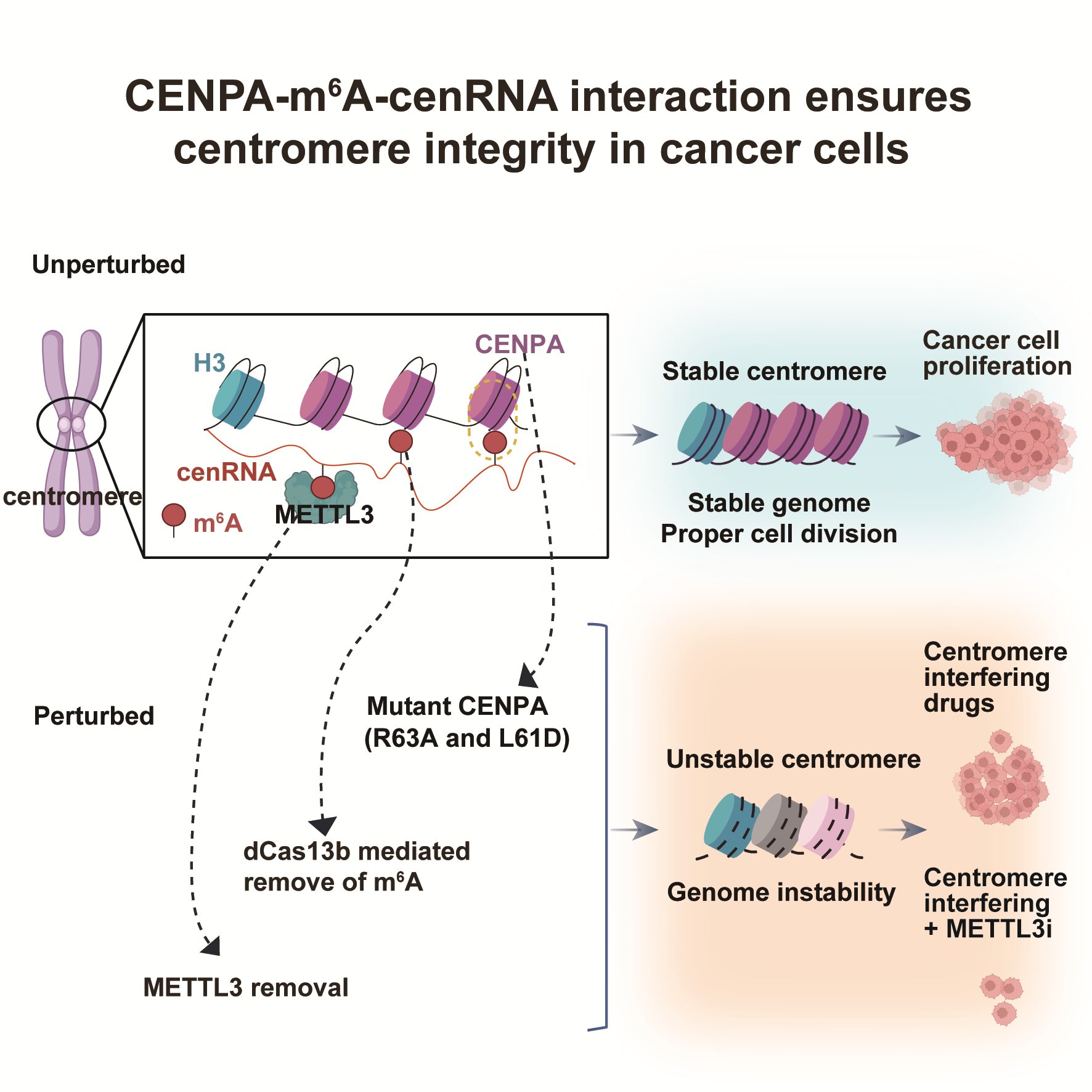
图1. CENPA-m6A-cenRNA调控着丝粒稳态和肿瘤耐药性。
综上,此项研究首次发现着丝粒区域的重复序列转录产物cenRNA拥有特异的m6A 修饰“阅读器”, CENPA。CENPA在传统上被认为是着丝粒特异性组蛋白。本研究发现CENPA通过与m6A-cenRNA的互作,在RNA表观遗传层面直接调控癌细胞中着丝粒完整性。这提出了RNA表观转录参与核小体功能及表观遗传信息传递的新视角,为深入理解着丝粒形成、维持与调控提供了新的机制。破坏这一机制会导致癌细胞染色体分离异常和基因组不稳定,抑制癌细胞生长及增强其对着丝粒干扰剂的敏感性,为癌症治疗开发新的靶向策略提供了重要依据。
北京大学生命科学学院、北大-清华生命科学联合中心、北京大学核糖核酸北京研究中心刘君研究员与清华大学生命科学学院杨雪瑞副教授为本文共同通讯作者。北京大学前沿交叉学科研究院2020级博士研究生康自红与清华大学生命科学学院2020级博士研究生李瑞萌为本文共同第一作者。北京大学生命科学学院李晴教授,北京大学化学与分子工程学院王欢研究员,中国科学院杭州医学研究所张亮研究员,南京大学医学院附属鼓楼医院王雷主任,北医三院司文喆副研究员为本工作提供了重要支持和贡献。
原文链接:
https://doi.org/10.1016/j.cell.2024.08.040