在哺乳动物中,雌性(XX)与雄性(XY)细胞具有性染色体二态性。为了平衡基因表达水平,在胚胎发育早期,雌性细胞内一条X染色体会发生转录失活(X chromosome inactivation, XCI)。X染色体失活异常,会引起严重的胚胎发育缺陷,多种人类智力缺陷疾病,甚至胚胎死亡。因此研究X染色体失活及其调控机制具有重要的科学意义和临床价值。X染色体失活伴随着剧烈的X染色质结构变化,最终呈现为凝缩的异染色质状态,被称为“巴氏小体”。 之前对体外小鼠胚胎干细胞(mESC)分化过程的研究发现,失活X染色体的拓扑结构域(TAD)和区室(compartment)结构都明显减弱,同时出现了以宏卫星序列Dxz4为边界的超级结构域(Dxz4-separated megadomains,D-megadomains)。颉伟实验室和合作者前期围绕染色体三维结构在哺乳动物生殖和胚胎发育过程中的变化规律和功能进行了一系列研究,包括精子发生(Wang et al., Mol Cell, 2019),卵子发生(Du et al., Mol Cell, 2020),着床前胚胎(Du et al., Nature, 2017),着床后胚胎(Zhang et al., Nat Genet, 2018; Xiang et al., Nat Genet, 2020)和核移植过程(Zhang et al., Mol Cell, 2020)等。然而,染色体三维结构在雌性胚胎发育早期X染色体失活过程中的动态变化过程、机制和功能仍不清楚。
2024年9月10日,清华大学生命科学学院颉伟研究组、王海峰研究组与美国密歇根大学医学院Sundeep Kalantry研究组合作在《自然遗传》杂志(Nature Genetics)发表了题为“《早期胚胎发育中失活X染色高级结构的从头建立》(Stepwise de novo establishment of inactive X chromosome architecture in early development)”的研究论文,系统性描绘了小鼠胚胎失活X染色体三维染色质构象的从头建立过程,其中首次报道了胚胎发育早期失活的X染色体呈现出一种特殊的染色质高级结构(Xist-separated megadomains, X-megadomains),并深入探究了其形成的分子机制和参与平衡失活X染色体上必要基因激活和全局性转录沉默的潜在功能,为深入理解X染色体失活机制以及染色体高级结构与基因转录调控关系提供了重要参考。
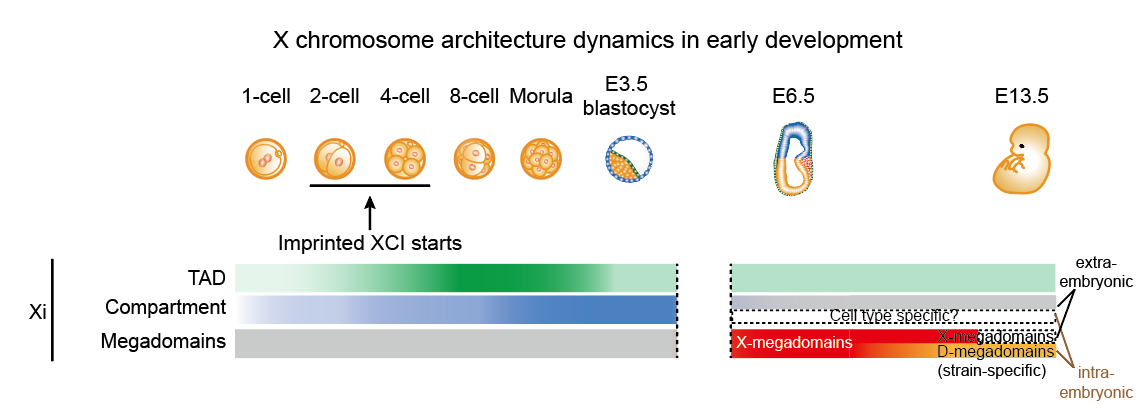
图1. X染色体高级结构在小鼠胚胎发育过程中的动态变化
小鼠胚胎发育过程中,X染色体失活受到精确而动态地调控。从4-细胞时期开始到囊胚期,父源X染色体发生特异地印记失活(Imprinted XCI)。之后,父源X染色体在胚外组织中维持印记失活状态,而在胚胎细胞中,其首先被短暂地重新激活,然后父源或者母源X染色体发生随机失活(Random XCI)。在这一工作中,研究人员利用课题组开发的高灵敏sisHi-C技术,系统分析了从1-细胞胚胎到E9.5胚外组织以及E13.5胚胎细胞的X染色体三维结构,涵盖了X染色体印记失活和随机失活的建立和维持过程。研究者发现,小鼠胚胎X染色体失活过程中TAD和compartment结构呈现出和mESC分化相似的减弱趋势(图1)。但是在小鼠着床后胚胎的胚外组织中出现了一种独特的以Xist位点为边界的超级结构域,因此将其命名为Xist-separated megadomain(X-megadomains)。这一结构在胚内组织发生随机X染色体失活的初期也短暂地出现。之前报道的D-megadomain则主要在胚胎发育后期出现,并只出现在部分小鼠品系中(图1)。X-megadomains在体外培养的胚外内胚层干细胞(XEN)也存在,并且能够被3D RNA/DNA FISH验证。
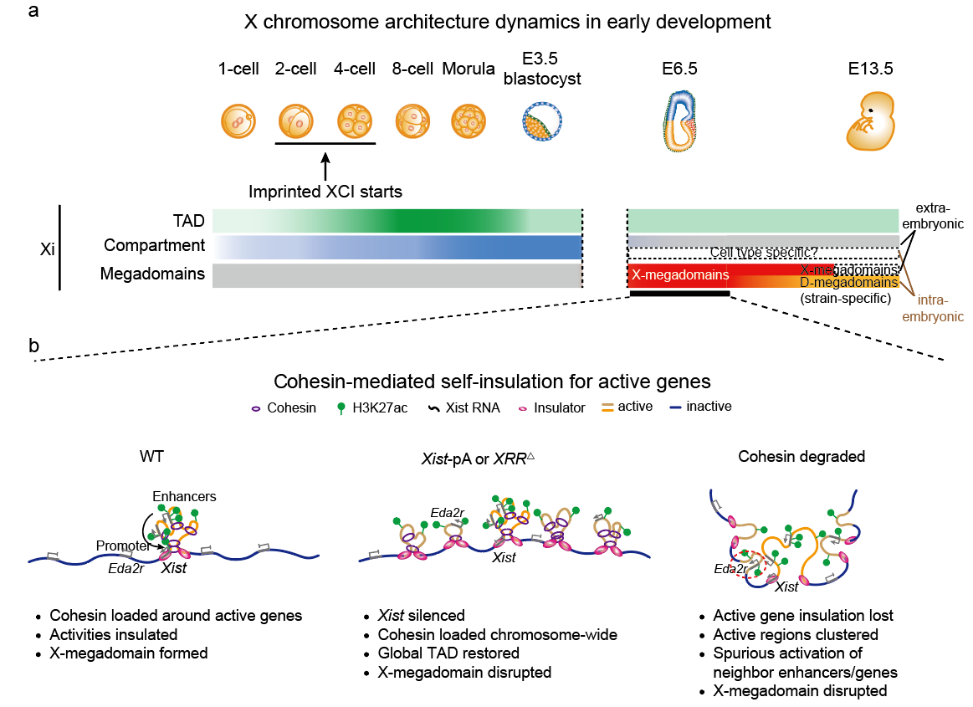
图2. 黏连蛋白(Cohesin)介导的失活X染色体上活跃转录基因的自我隔离
研究人员进一步发现,X-megadomains的形成与Xist基因上游调控区域(Xist Regulatory Region, XRR)的增强子活性以及黏连蛋白(Cohesin)结合具有很好的相关性。在XEN细胞中敲除XRR区域、沉默Xist表达或特异性诱导Cohesin降解,都会破坏X-megadomains,而降解CTCF对X-megadomains结构的影响较小。结合之前研究报道的组蛋白乙酰化可以通过乙酰化识别器BRD4进而招募Cohesin的装载(loading)蛋白NIPBL,研究人员提出了X-megadomains形成的分子机制:早期胚胎中Xist基因上游调控区域(XRR)高度活跃的增强子信号促进Cohesin在该区域大量装载,导致Cohesin在附近区域大量积累,并通过环挤压(loop extrusion)形成X-megadomains(图2)。进一步研究发现,X-megadomains被破坏后,Xist位点附近基因和转录调控序列异常激活,提示Cohesin在Xist和XRR区域的富集可能使得附近活跃的DNA区域自我隔离,以阻止其转录活性向周边区域扩散,从而避免周围转录沉默基因的异常激活。因此,通过活跃增强子介导的Cohesin装载和活跃基因的自我隔绝,细胞可以更好地维持失活X染色体上必要的基因激活和全局性转录沉默(图2)。综上所述,这一工作揭示了小鼠胚胎失活X染色体高级结构的从头建立过程,以及其潜在的基因调控功能。
清华大学颉伟教授、王海峰助理教授和美国密歇根大学Sundeep Kalantry教授为本文的通讯作者,清华大学生命学院博士后杜振海、2019级博士生胡梁俊、2018级博士生邹卓宁和2019级博士生刘美铄为本文共同第一作者。清华大学生命学院2022级博士生李梓晗、清华大学生命学院博士后卢绪坤、美国密歇根大学医学院Clair Harris、重庆医科大学教授向云龙、清华大学生命学院博士后陈凤玲、于广、许锴和2022级博士生孔凤也在该课题中做出了重要贡献。该课题得到了清华大学实验动物中心的大力协助和支持。本研究获得了国家自然科学基金会、国家科技部重点研发计划、清华-北大生命科学联合中心、美国国立卫生研究院 (NIH) 国家普通医学科学研究所 (NIGMS)、美国国立卫生研究院 (NIH)国家儿童健康与人类发展研究所 (NICHD)和中国博士后科学基金的经费支持。王海峰助理教授受到清华大学笃实专项计划和本源公益基金资助。颉伟教授是HHMI国际研究学者和新基石研究员。
论文链接:https://www.nature.com/articles/s41588-024-01897-2