微管(Microtubule)的动态不稳定性对其正常生理功能至关重要,这一过程依赖于多种微管蛋白(Tubulin)亚型在微管末端的组装与去组装。微管蛋白突变与多种人类疾病密切相关,因此,在活细胞中对微管蛋白进行可视化标记是研究其功能的关键策略,对于理解微管的动态调控以及解析相关疾病的病理机制具有重要意义。然而,现有方法在活细胞内对微管蛋白低损伤、特异性和高效率标记方面存在显著局限(如绿色荧光蛋白(GFP)标记对微管蛋白的功能和定位产生较大影响,而免疫荧光染色无法对微管的动态行为进行研究),限制了对微管蛋白精确功能的理解以及相关疾病机制的阐释。
2024年8月19日,清华大学生命科学学院/北京生物结构前沿研究中心欧光朔课题组在《公共科学图书馆·生物学》(PLOS Biology)杂志在线发表了题为“利用AlphaFold2优化split-GFP技术对内源微管蛋白进行功能型荧光标记”(AlphaFold2-guided engineering of split-GFP technology enables labeling of endogenous tubulins across species while preserving function)的方法学论文。该研究利用人工智能(Artificial Intelligence, AI)软件AlphaFold2的结构预测能力,发展了能够在活细胞内对微管蛋白进行低损伤、高效率荧光标记的新技术。
论文作者利用人工智能技术AlphaFold2,在split-GFP荧光互补标记技术的基础上进行了关键改进。作者首先将16个氨基酸的GFP11短标签精准插入至α-或β-微管蛋白的非保守H1-S2 loop区,然后利用AlphaFold2进行结构预测,优化了GFP11两端的连接子序列,确保GFP11与GFP1-10互补片段之间的稳定互作,从而产生更强的荧光信号(图1 A)。通过AI技术的辅助,以及结构匹配和分子模拟结果表明,该策略(GFP11-i)成功将split-GFP蛋白标记在微管的中空管腔内侧,既不影响微管蛋白的折叠成熟过程,也不破坏微管的整体结构与基本功能(图1 B-C)。
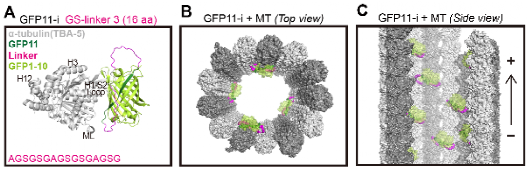
图1. 利用AlphaFold2对split-GFP标记微管蛋白的策略进行优化
进一步,作者在秀丽隐杆线虫中采用基因敲入(knock-in)策略,对内源的α-或β-微管蛋白进行了GFP11-i标记。结果显示,与传统的GFP标记方法相比,GFP11-i标记对体内如胚胎分裂、纤毛发生等与微管相关的重要生物过程的干扰更小,同时实现了对内源微管蛋白亚型的组织特异性标记,并且能够对突变微管蛋白进行高保真(低损伤)的活体标记与动态示踪。通过在人源HeLa细胞系中转基因表达GFP11-i标记的人源微管蛋白TUBA1A(图2 A),以及在小鼠卵细胞中表达GFP11-i标记的TUBA4A(图2 B),该研究展现了GFP11-i在哺乳动物系统中对微管蛋白的高标记效率。
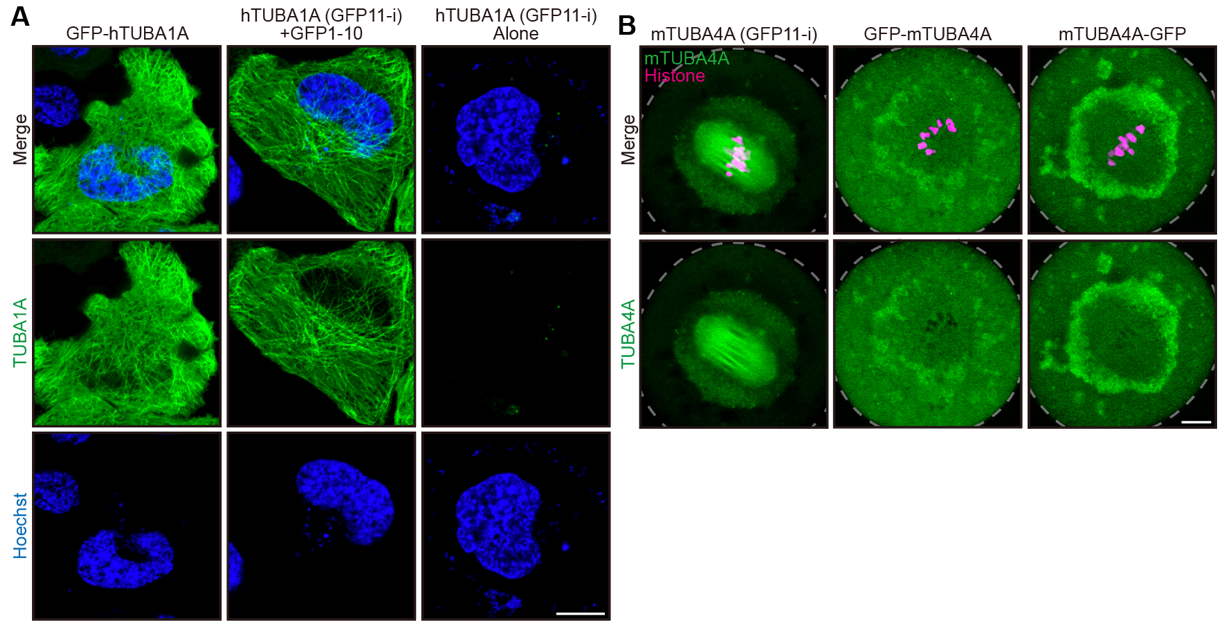
图2. GFP11-i在哺乳动物系统中高效率标记微管蛋白
最后,为了探究GFP11-i能否高效标记带有人类疾病突变的微管蛋白突变体,作者将已知与人类不育相关的α-微管蛋白TUBA4A(E284G)突变体表达在HeLa细胞系中,发现该疾病突变体严重破坏了微管网络的形态(图3A-C)。进而,作者分别表达了传统GFP标记或GFP11-i标记的TUBA4A(E284G),发现GFP标记严重干扰其病理学表型,而GFP11-i则能够高保真地对突变体微管蛋白进行活细胞荧光标记(图3 A-C),提示其在微管蛋白相关疾病研究中的重要应用潜力与价值。
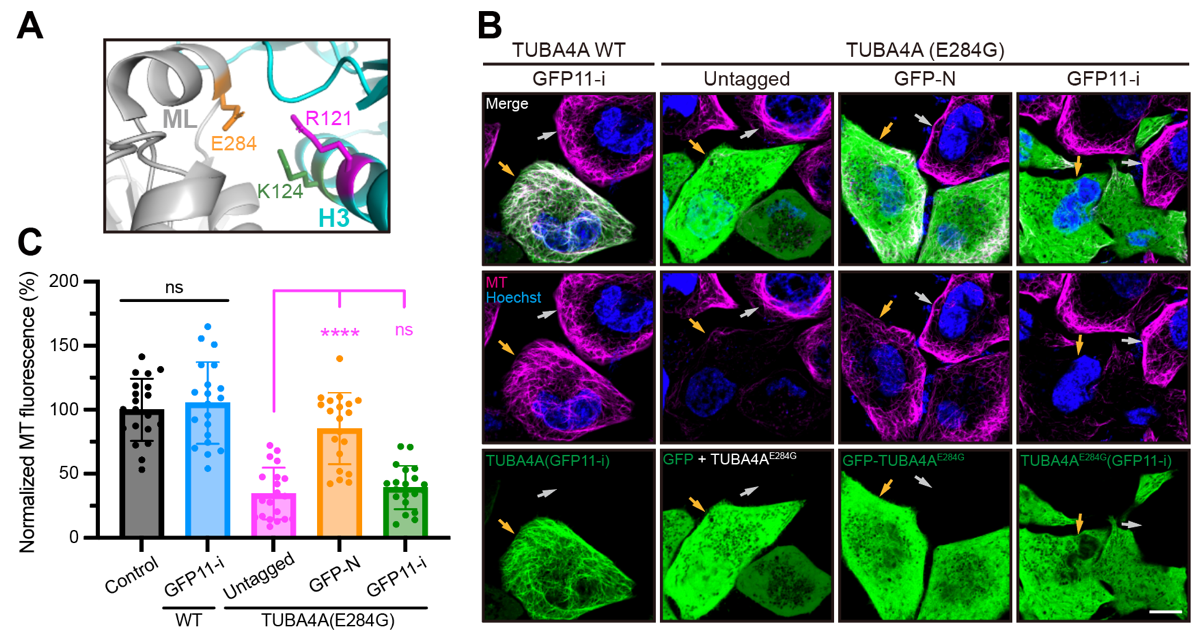
图3. GFP11-i能够高保真标记疾病突变体微管蛋白
综上,该研究利用AlphaFold2的结构预测功能,借助split-GFP荧光标记技术发展了微管蛋白的功能型荧光标记新方法,能够在不影响微管蛋白的结构与功能的前提下对其进行活细胞标记与示踪,该方法在微管蛋白相关疾病的研究中展现出重要的应用潜力与价值。
欧光朔教授为本文的通讯作者,2021级博士生许凯铭为第一作者。清华大学杨雪瑞课题组的2018级博士生李志原,那洁课题组的2021级博士生毛林凡,欧光朔课题组的2023级博士生郭正阳等同学参与了本项目部分研究。该研究得到了国家自然科学基金委、国家重点研发计划以及许凯铭获得的国自然青年学生基础研究项目等的经费支持。
原文链接:https://doi.org/10.1371/journal.pbio.3002615