组成型异染色质由高度凝聚的染色质组成,通常包括着丝粒和着丝粒周围区域。它在染色质组织、转座子沉默和基因组稳定性中起着至关重要的作用。在很多物种中,DNA重复序列和转座子(TE)在组成型异染色质区域高度富集,并被DNA甲基化和抑制性组蛋白修饰所沉默。ADCP1是植物基因组中异染色质组蛋白修饰H3K9me2的阅读器,在调控异染色质形成、H3K9me2和CHG/CHH甲基化维持,以及转座子沉默中发挥关键作用。
在间期细胞核中,组成型异染色质可以被DAPI染色成致密的细胞核结构,被称为染色中心。染色质中心是凝聚和沉默组成型异染色质区域的细胞组织形式。有趣的是,在不同的植物物种中,异染色质的组织和抑制性组蛋白修饰的分布存在显著的多态性,染色中心的存在与否也有明显的细胞核形差异,然而其内在调控机制尚不清楚。
2024年7月16日,清华大学生命学院孙前文实验室在《自然·植物》 (Nature Plants)杂志上发表了题为“异染色质凝聚体的进化调控植物中染色中心的形成和转座子沉默” (Evolutional heterochromatin condensation delineates chromocenter formation and retrotransposon silencing in plants) 的研究论文。该研究揭示了植物异染色质蛋白ADCP1通过与其互作蛋白HMGA以及异染色质进行多价态互作介导的相分离,促进染色中心的形成和转座子沉默。不同植物中ADCP1同源蛋白无序区域的结构变异在进化上影响了染色中心的形成和转座子在基因组内的分布。
为了探究植物界染色中心形成的调控机制,研究人员通过对处于细胞间期的叶片细胞核进行DAPI染色和异染色质标记H3K9me2和H3K27me1的免疫荧光分析,系统检测了60种不同植物物种中异染色质的组织形式。发现在所检测的物种中,仅有十字花科植物及其近缘物种醉蝶花,以及葫芦科植物具有典型的染色中心(图1)。通过对各物种中的ADCP1同源蛋白进行序列比对分析,发现ADCP1蛋白在不同植物中则存在显著的序列差异(图1 a和b):在白菜、萝卜等十字花科植物以及醉蝶花中,ADCP1同源蛋白的序列与拟南芥中的ADCP1具有相似的结构特性 (3对Agenet结构域通过两个linker连接),这些物种具有与拟南芥类似的典型染色中心(图1 a和b);而在与十字花科亲缘关系略远的物种木瓜中,ADCP1同源蛋白则保留了两对Agenet结构域和一个linker区,其细胞核内仍可见存在相对弥散的染色中心(图1 a和b);在黄瓜、南瓜等葫芦科植物中,ADCP1同源蛋白只在N端有一对Agenet结构域,之后是长的无序区域,其中包含两个AT-hooks基序,这些物种的细胞核中也有明显的染色中心(图1 a和b);而在大豆、烟草等其它检测的双子叶植物中,ADCP1同源蛋白则缺失了一对Agenet结构域和两个linker区域,这些物种的细胞核内异染色质呈弥散分布(图1 a和b);另外,在水稻、小麦等单子叶植物中,ADCP1的同源蛋白存在两个linker区域的缺失,这些物种的细胞核内同样不存在典型的染色中心(图1 a和b);在进化中起源较早的裸子植物、苔藓和蕨类等物种中,ADCP1同源蛋白只有一对Agenet结构域,这些物种的细胞核内异染色质分布同样较为弥散(图1 a和b)。研究人员推测ADCP1同源蛋白的结构域变异可能影响了染色中心的形成。
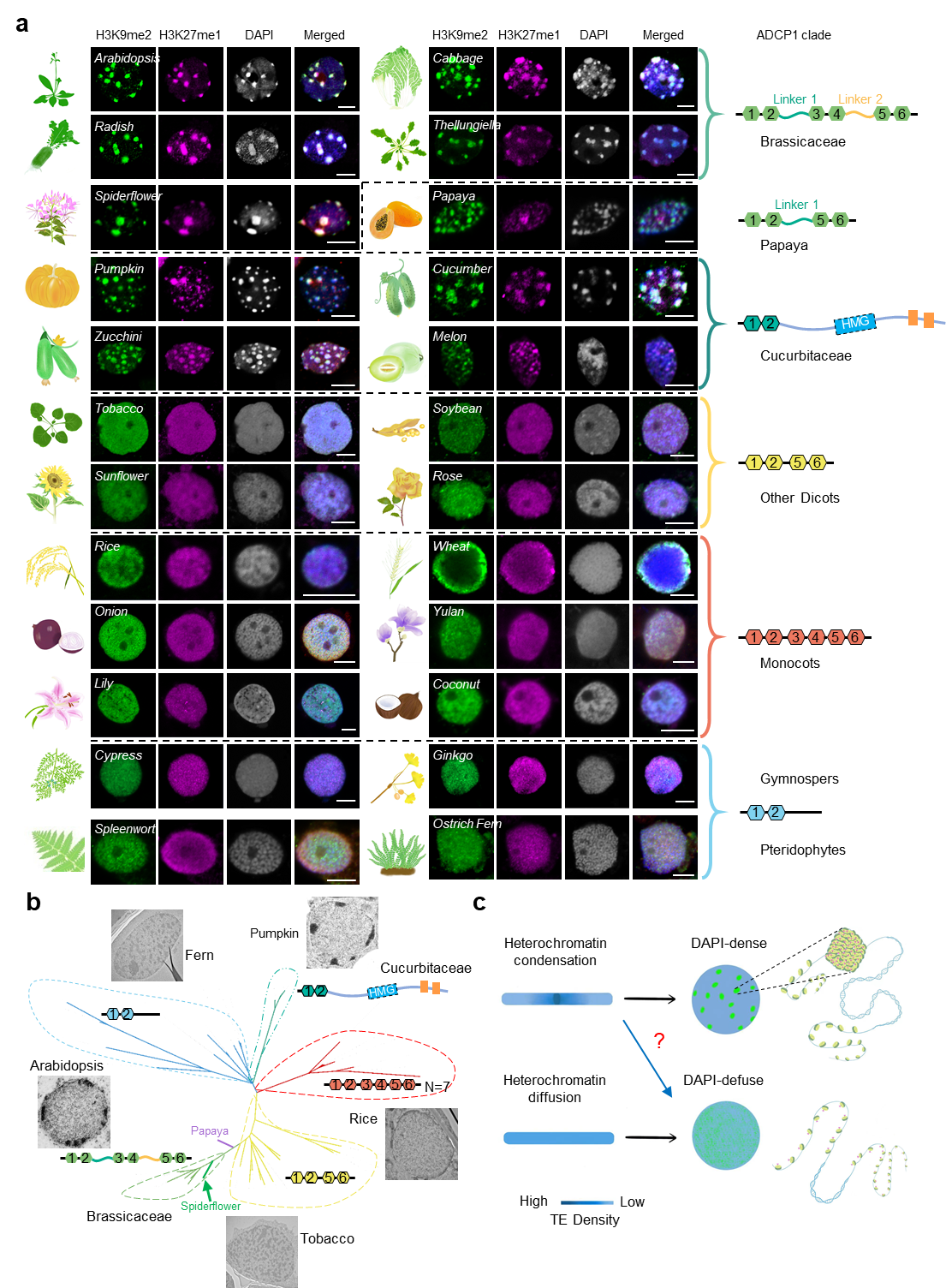
图1 不同植物物种染色中心存在与否与ADCP1蛋白结构变异相关
为了探究ADCP1调控染色中心形成的分子机制,利用模式十字花科植物拟南芥,研究人员通过免疫共沉淀和质谱分析,鉴定出了一个ADCP1的潜在互作蛋白HMGA(High Mobility Group A),并发现二者的相互作用发生在染色中心。进一步发现,ADCP1和HMGA蛋白中的无序区域会影响蛋白复合体在染色中心的特异定位以及体外的相分离能力。在hmga突变体中,ADCP1在其结合位点上的结合丰度显著降低。进一步发现HMGA蛋白倾向于结合ADCP1结合区域的两侧。研究人员由此推测HMGA可能通过结合于H3K9me2阅读器ADCP1介导沉默的异染色质区域两侧,通过与ADCP1互作将异染色质区域进行区隔和浓缩,使其维持沉默状态,防止转座子被激活而对基因组稳定产生危害。
实验人员进一步通过实验证实,拟南芥ADCP1蛋白中具有相变能力的linker区是调控染色中心形成的关键,且该无序区域的氨基酸特性决定了其相变能力。然而葫芦科植物黄瓜的ADCP1同源蛋白 (CsaADCP1) 的Agenet结构域后面具有一个潜在的HMG结构域和两个AT-hook基序(图1)。因此从蛋白质结构上看,CsaADCP1蛋白类似于拟南芥ADCP1和HMGA两个蛋白在进化上发生融合而形成的嵌合蛋白。通过实验发现,CsaADCP1蛋白中长段的无序区决定了其相变能力,促进了染色中心的形成。进一步在烟草中稳定表达拟南芥ADCP1-HMGA蛋白会促进细胞核内异染色质伴随ADCP1-HMGA发生凝聚,产生了类似染色中心的区域。同时ChIP-seq检测发现,ADCP1蛋白在烟草基因组中也结合在富集H3K9me2标记的LTR型转座子上。进一步检测被ADCP1结合的LTR型TE的表达,发现在表达拟南芥ADCP1及加入拟南芥ADCP1的linker区域的NbADCP1蛋白的烟草转基因植株中,这些转座子的表达较未转化的对照显著下降,表明这些转座子被ADCP1的结合所沉默。
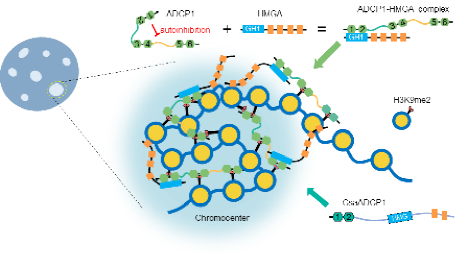
图2 ADCP1-HMGA促进染色中心形成的工作模型
根据以上的结果,作者提出了一个模型(图 2):ADCP1蛋白中两个linker区具有相变能力,而Agenet1/2结构域则会抑制ADCP1的自身相变。HMGA蛋白通过与ADCP1的Agenet1/2结构域结合,解除其对相变的抑制,从而促进ADCP1蛋白的相变。此外,HMGA中的AT-hooks区域赋予了HMGA相分离的能力,并且与异染色质区域的AT-rich DNA结合,促进该区域的凝聚。已有的结果表明ADCP1蛋白的6个Agenet结构域均具有结合异染色标记H3K9me2的能力(Cell Research 2019),这一特性进一步促进了异染色质区域的浓缩,使异染色质区域形成了与其它染色质区域相比更加凝聚的特性,降低了该区域的染色质可及性,从而维持了该区域内转座子的沉默和基因组的稳定。在漫长的进化过程中,葫芦科物种进化出了另外一种蛋白形式:ADCP1和HMGA的功能结构域发生融合,形成一种新的嵌合蛋白,同时结合H3K9me2和DNA,并具有自身相分离的能力,从而促进异染色质区域的浓缩,维持转座子的沉默。
清华大学生命科学学院博士后张卫峰为该论文第一作者,清华大学生命科学学院、清华-北大生命科学联合中心孙前文副教授为本文通讯作者。该工作得到了清华大学李海涛教授、李丕龙副教授和陈春来副教授的指导和帮助,孙前文实验室2014级博士研究生程玲玲(已毕业)、2018级博士研究生李宽博士(已毕业)、在读博士研究生雷雪(2021级)和江安洁(2020级),李丕龙实验室2017级博士研究生谢雷鸣(已毕业),陈春来实验室2018级博士研究生纪瑾瑶也参与了该研究。该工作得到国家自然科学基金、清华-北大生命科学联合中心、中国博士后科学基金等经费的支持。
本研究为孙前文实验室植物异染色质形成机制和功能的系列工作之一(Zhao et al., Cell Research 2019; Zhou et al., The Plant Journal 2020; Zhou et al., Science Advances 2023; Zhang et al., Nature Plants 2024)。孙前文实验室目前正在招聘博士后开展后续相关研究,欢迎感兴趣的申请人联系:sunqianwen(a)mail.tsinghua.edu.cn(请将’(a)’替换为’@’)。
原文链接:https://www.nature.com/articles/s41477-024-01746-4