二十世纪五十年代,Barbara McClintocks首次在玉米中发现一类能在基因组中移动、改变自身位置的DNA序列——转座子,并在1983年获得诺贝尔生理学或医学奖。人类基因组中有接近一半的序列由转座子构成,其中,LINE-1 (Long interspersed nuclear element-1, L1) 占据了人类~17%的基因组序列,是目前人体内唯一活跃且具有自主逆转录转座能力的转座子。尽管L1在体细胞中的表达通常受到抑制,但L1在人和小鼠早期胚胎发育的合子基因组激活(zygotic genome activation,ZGA)过程中却瞬时高表达。这不仅说明L1的表达受到极其严格和精确的调控,而且暗示L1的表达在关键生理过程具有重要作用。然而,关于L1表达是如何被调控的,以及L1在基因调控和ZGA中的功能还知之甚少。

2024年6月7日,清华大学生命学院刘念课题组在《自然遗传》(Nature Genetics)上在线发表题为“LINE-1反转录转座子激活远程基因表达”(LINE-1 transcription activates long-rang gene expression)的研究论文。该研究提供了第一个关于L1表达调控的全基因组筛选结果,系统性鉴定并验证了L1在长程基因激活中的广泛作用, 阐释了L1转录如何促进早期胚胎中ZGA过程的顺利进行,为理解L1在发育和疾病中的生理学功能提供一个新视角。
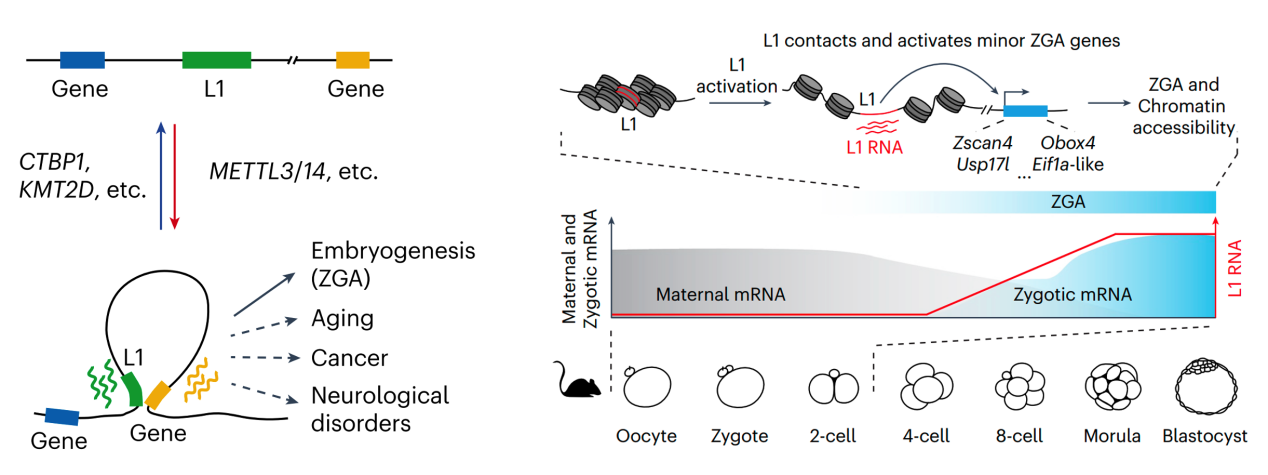
图1. L1的转录水平被功能多样的基因所精密调控,也决定着L1选择性地接触并激活远程基因表达的功能,影响着早期胚胎发育中的ZGA,也可能影响衰老、癌症和神经系统性疾病等(左)。L1转录激活了小鼠早期胚胎发育中的第一波转录行为(minor ZGA)(右)。
刘念课题组长期从事逆转录转座子调控和功能研究。在之前的工作中,系统鉴定了L1转座过程的调控因子 (Liu et al. Nature 2018),并发现L1可以作为拓扑结构域边界(Hong et al. Molecualr Cell 2024)。进一步研究发现,很多影响L1表达的调控因子与增强子的调控和功能相关(KMT2D, CTBP1, METTL3,METTL14等),这提示L1可能具有增强子活性。通过系统性挖掘全基因组自转录活性调控区测序(STARR-seq)数据,作者发现L1 5’ 非翻译区(5’ UTR)具有增强子特征,可以通过不依赖其位置或方向的方式激活基因表达。作者使用CRISPRa/i系统靶向L1 5’ UTR,发现 L1 可以直接与其远端靶基因物理接触,当L1被激活时,L1与基因的相互作用变得更强;但当L1被沉默时,L1 与基因的接触则会减弱。
为了探究L1在ZGA过程中的作用,作者首先比较了人和恒河猴基因组中L1插入及早期胚胎发育过程中基因的表达变化,发现L1的谱系特异性插入可能增强ZGA基因表达。进一步分析发现,小鼠中L1的5’ UTR上也富集增强子信号。因此,作者使用CRISPRa/i和L1 ASO在小鼠胚胎干细胞中操纵L1表达,发现L1选择性调控二细胞期特异基因的表达。小鼠胚胎发育过程中的scRNA-seq和Hi-C公共数据表明L1在early 2-cell时期就开始表达,并且直接与minor ZGA基因互作并激活其表达。作者通过在小鼠胚胎的合子时期注射L1 ASO,发现L1的敲低会损害合子基因组激活并使小鼠胚胎发育阻滞在二至四细胞期。
综上,本研究提供了功能多样的L1表达调控因子,发现并验证了L1 5’ UTR作为增强子在早期胚胎发育阶段以转录依赖的方式直接与ZGA基因互作并激活其表达。由于L1的活跃转座使其仍在人基因组中扩增,因此L1可能在人类基因组中持续增添新的顺式DNA调控元件,进而影响着人类的多种疾病和发育过程。该工作为研究L1的调控网络提供了丰富的资源,揭示了L1表达调控的复杂性和多样性;解释了为什么L1在胚胎发育过程中被激活,为理解L1在基因组中的功能提供了新的视角。
清华大学生命科学学院、清华-北大生命科学联合中心刘念副教授为本文的通讯作者。清华大学生命科学学院2019级博士生李秀峰、博士后别路垚、CLS项目2016级博士生王洋(已毕业)、博士后洪雅强为本文共同第一作者。研究得到了清华大学生命科学学院颉伟教授、孟安明教授、郗乔然副教授,清华大学医学院沈晓骅教授,清华大学生命学院实验动物中心常在、张静的大力帮助。研究得到清华-北大生命科学联合中心、北京生物结构前沿研究中心、国家重点研发计划、国家自然科学基金、清华大学自主科研计划、本源公益基金等的支持。
原文链接:https://www.nature.com/articles/s41588-024-01789-5