大脑新皮层(neocortex)是哺乳动物神经系统的最高级中枢,由数量庞大、种类繁多的神经细胞有序分布组装形成的规则层状结构,调控感知﹑运动﹑语言和认知等所有高级神经功能。然而,如何在发育过程中形成大脑新皮层这一高度复杂且有序的结构,一直是发育生物学和神经生物学的未解之谜。
大脑新皮层神经元起源于胚胎发育中的放射状胶质前体细胞(radial glial progenitors, RGPs)。在神经发生(neurogenesis)时期,RGPs通过不对称分裂产生一个保留RGP特性的子代细胞和一个神经元或中间神经前体细胞(intermediate progenitors, IPs)。IPs可进行有限的分裂,产生两个或多个神经元。由单个RGP分裂产生的同谱系的子代神经元克隆(clone),在皮层中柱状聚集分布。值得注意的是,不同RGP产生的克隆的神经元数目和空间分布特性存在明显差异。因而,解密变化的RGP神经元克隆如何稳定且高效地构建几乎不变的大脑新皮层,是理解大脑新皮层发育组装的一个核心问题。
2023年9月15日(近期上线),清华大学生命科学学院、清华-IDG/麦戈文脑科学研究院、北京生物结构前沿研究中心、新基石科学实验室时松海课题组在《国家科学评论》(National Science Review)杂志发表了题为 “变化的神经前体细胞克隆如何构建相对不变的大脑新皮层”(How variable progenitor clones construct a largely invariant neocortex)的研究论文。该研究系统定量分析了胚胎发育过程中,小鼠大脑新皮层单个RGP所产生子代兴奋性神经元的数目和层状分布特性,阐明了大脑新皮层神经元稳定产生的细胞机制,揭示了单个RGP神经元克隆的数目和层状分布的发育变化规律及分子细胞基础。
在该研究中,研究人员利用先进的双标记嵌合体分析技术(Mosaic Analysis with the Double Markers,MADM),在体稀疏荧光标记特定胚胎期小鼠大脑新皮层中进行分裂的RGPs及其子代兴奋性神经元。通过全脑三维重构获取单个RGP神经元克隆的神经元数目和空间分布特征,定量解析单个RGP在不同发育时间节点的分裂行为与神经元产出。研究发现,在小鼠大脑新皮层神经发生阶段(胚胎期12~16天),RGP神经元克隆的多样性呈现规律性变化特征(图1)。不同发育时间节点标记的RGP克隆的神经元数目符合连续变化的泊松分布模型,提示RGPs以相对恒定的速率(~1.6个/天)产生神经元。同时,单个RGP克隆的神经元的层状分布不是随机的,而是会倾向于分布在某一细胞层;并且,不同RGP克隆倾向分布的细胞层不同,这主要是由相对有限的IP产生所影响的。

图1:RGP神经元克隆的神经元数量和层分布表现出规律的变化特征
通过系统分析RGP克隆在连续时间节点的特征,并利用神经元依赖出生时间 “由内向外”的迁移规律,实现了对RGP克隆中神经元的空间排布特征的有效预测。最终,该研究将神经元产生和分布的规律与RGPs的分裂行为相结合,成功建立了数学模型,实现了体外模拟变化的RGP克隆构建成接近于真实大脑新皮层的神经结构(图2)。该研究揭示了在复杂有序的大脑新皮层发育形成过程中,神经元产生的稳定性与变化性的有机平衡,为深入理解大脑新皮层的结构组装奠定了坚实的基础。
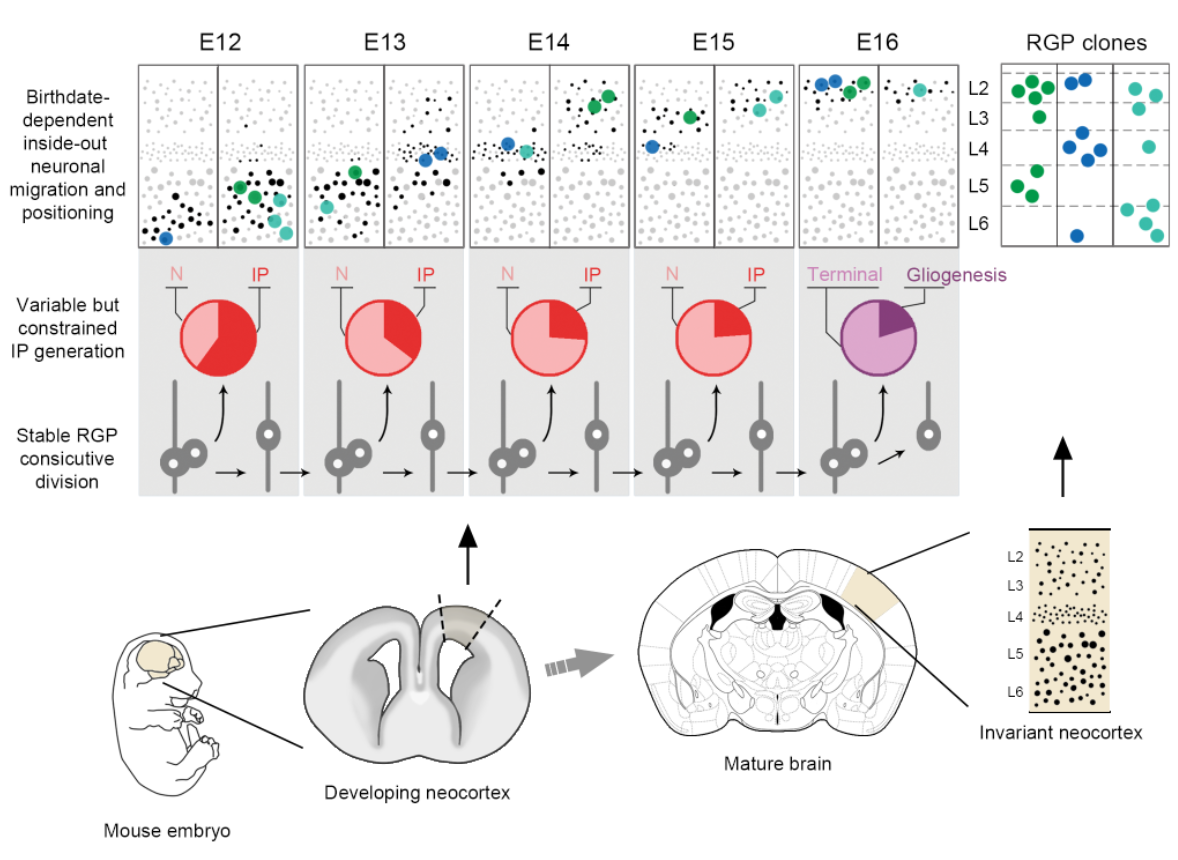
图2:规律变化的神经干细胞克隆产生不变的大脑新皮层
清华大学生命科学学院时松海教授为本文通讯作者,马健助理研究员为本文共同通讯作者,已出站博士后﹑清华大学水木学者沈忠福博士﹑清华大学生命科学学院2017级博士研究生杨嘉俊﹑张强强博士和清华大学计算机科学与技术系2021级博士研究生王夔宇为本文共同第一作者。清华大学计算机科学与技术系胡晓林教授为本研究做出了重要贡献。
本研究得到了英国剑桥大学Benjamin D. Simons教授的宝贵建议,并获得了科技创新2030—“脑科学与类脑研究”重大项目﹑国家自然科学基金委创新群体项目﹑北京市卓越青年科学家计划﹑北京市科技委员会科技计划﹑北京脑科学与类脑研究所与新基石研究员项目的资助。
论文链接:https://doi.org/10.1093/nsr/nwad247