γ-氨基丁酸(GABA)为人体中枢神经系统内重要的抑制性神经递质。在GABA能神经元中,当突触前膜去极化后,内含GABA的突触囊泡将融合到突触前膜,并释放GABA到突触间隙中。随后,GABA会结合突触后膜的GABAA受体,引发Cl-内流,使得突触后膜超极化,从而抑制神经冲动的传递。GABA转运体1(GAT1)负责将突触间隙的GABA回收至突触前膜神经元,从而调控下游受体的激活状态。GAT1维持着神经系统抑制微环路的稳定,其功能异常会导致多种神经类疾病,比如自闭症、癫痫、精神分裂症。GAT1是重要的抗癫痫靶点,通过阻断GAT1的功能可以抑制突触间隙中GABA的清除,进而减少神经冲动以减轻癫痫症状。1997年,美国FDA批准GAT1抑制剂噻加宾作为辅助治疗的癫痫的药物。此前Gati组在2022年报道了GAT1结合噻加宾的3.8埃的电镜结构[1],但是目前仍然缺乏高分辨率的结构信息来揭示GAT1对小分子底物GABA的识别和转运机制以及其它抑制剂如3-哌啶甲酸的抑制机制。
2023年7月3日,清华大学生命科学学院副教授闫创业课题组在自然-结构与分子生物学(Nature Structural & Molecular Biology)发布了关于GABA转运体GAT1的转运与抑制机制的重要成果。该工作通过结构生物学和生物化学相结合的手段阐明GAT1转运底物GABA的机制,揭示了竞争性抑制剂3-哌啶甲酸和非竞争性抑制剂抗癫痫药物噻加宾的抑制机制,为进一步靶向GATs的药物奠定了基础。

在本篇文章中报道了GAT1在无底物、结合内源底物GABA、竞争性抑制剂3-哌啶甲酸和非竞争性抑制剂抗癫痫药物噻加宾四种不同的结构,分辨率为2.2~3.2埃。其中无底物结合与结合噻加宾的结构为向内开口(inward-open)状态,结合内源底物GABA和竞争性抑制剂3-哌啶甲酸的结构为向内阻塞(inward-occluded)状态(图1)。
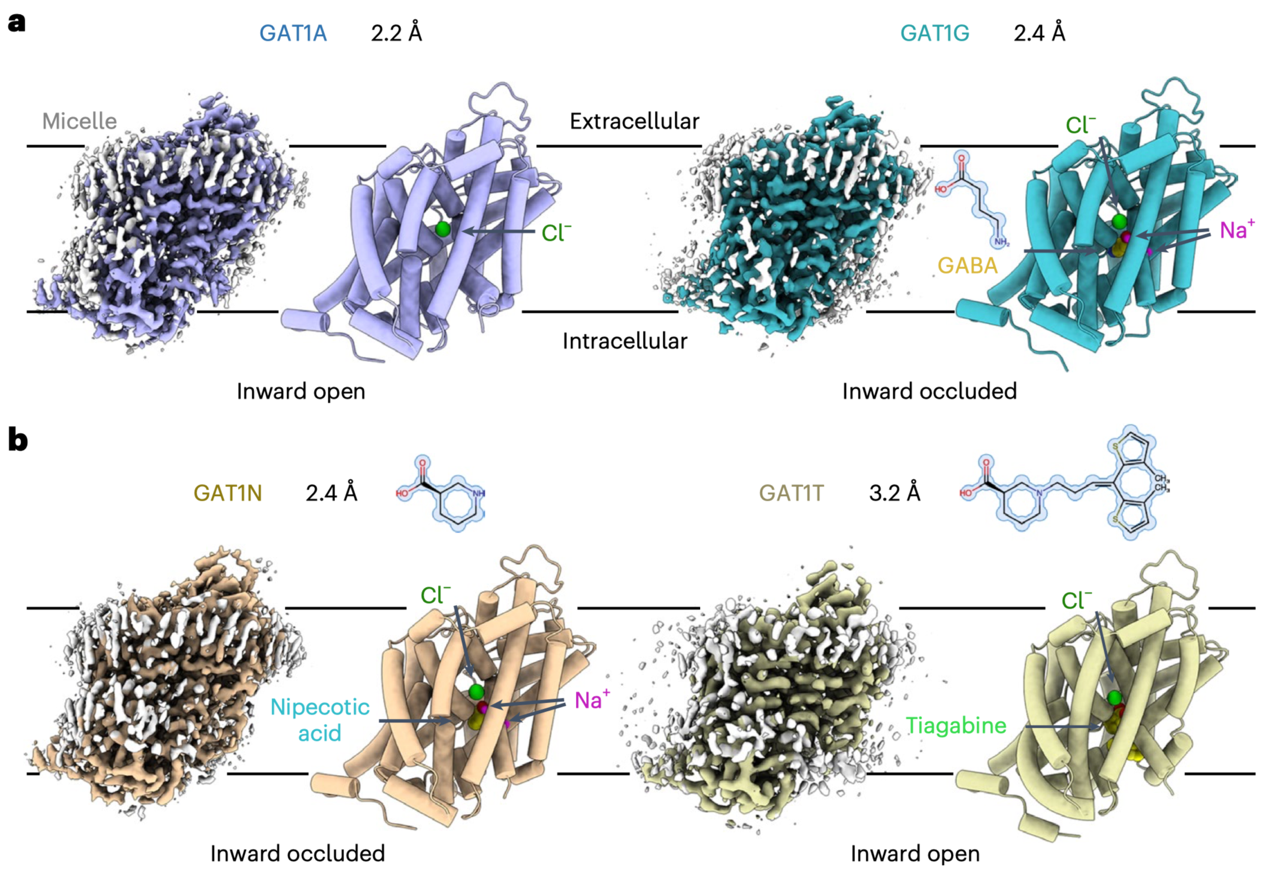
图1 GAT1在无底物状态及结合三种配体的结构
低分子量膜蛋白解析在冷冻电镜领域较为困难,一般需要较大可溶区或者纳米抗体的帮助。在此前闫创业课题组成功解析具有柔性可溶区的单羧酸转运体MCT1/Basigin-2复合物(3.0埃)[2]和无可溶区的葡萄糖转运体GLUT4(3.2埃)[3]的高分辨率三维结构。在这项工作中,研究人员在没有纳米抗体的条件下,进一步获得了2.2至2.4埃高分辨率的无底物结合和结合底物GABA的GAT1结构。
得益于高分辨率的电镜密度图,研究人员可以准确地将GABA、3-哌啶甲酸和噻加宾搭建出来(图2),同时在结构中也能清楚地观测到钠离子、氯离子和水分子。GABA和3-哌啶甲酸的羧基可以与钠离子、残基G65和Y140相互作用,而它们的氮原子可以与周围的水相互作用。通过对这些配体与GAT1的相互作用模式的分析,该研究提供了有关GAT1识别和转运底物以及抑制机制的重要见解。这项研究为进一步开发针对GATs的治疗神经疾病的药物提供了有价值的设计思路。
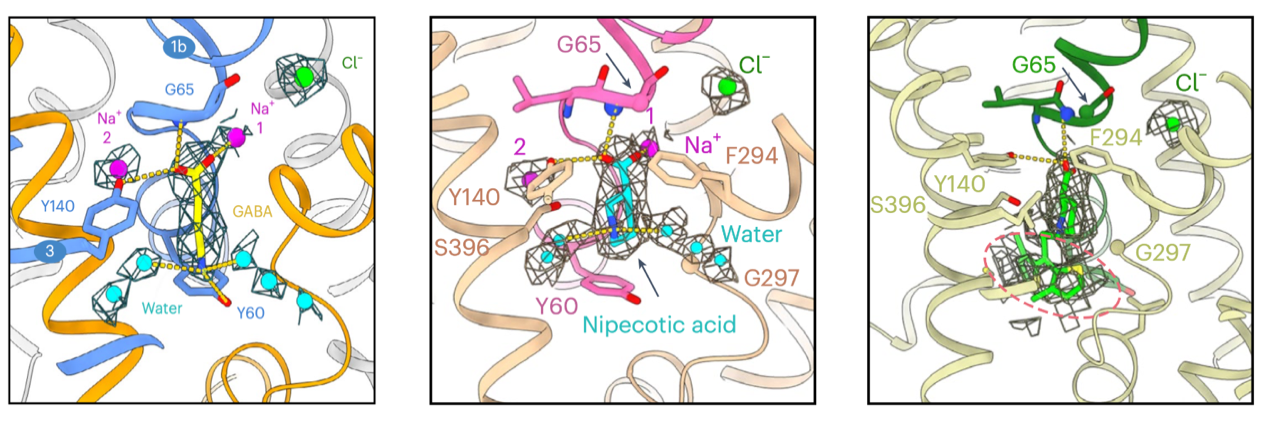
图2 GAT1与GABA、3-哌啶甲酸和噻加宾的互作模式
清华大学生命科学学院副教授闫创业和助理研究员袁亚飞为共同通讯作者;2019级博士生朱盎岐为本文的第一作者;2022级博士生黄隽豪、2021级博士生孔方和2019级博士生谭佳鑫对本研究提供了重要帮助;清华大学冷冻电镜平台主管雷建林博士为冷冻电镜数据收集提供了帮助。
实验的电镜数据采集受到清华大学冷冻电镜平台的支持,实验的计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本研究获得了国家自然科学基金重点研发计划、膜生物学国家重点实验室、北京市科技新星计划、北京高校卓越青年科学家计划项目、北京生物结构前沿研究中心与清华-北大生命科学联合中心的经费支持。
原文链接:https://doi.org/10.1038/s41594-023-00983-z
参考文献:
[1] Motiwala, Z. et al. Structural basis of GABA reuptake inhibition. Nature 606, 820–826 (2022).
[2] Wang, N. et al. Structural basis of human monocarboxylate transporter 1 inhibition by anti-cancer drug candidates. Cell 184, 370–383.e13 (2021).
[3] Yuan, Y. et al. Cryo-EM structure of human glucose transporter GLUT4. Nat. Commun. 13, 2671 (2022).