NPC(核孔复合体)是细胞内最庞大、最复杂的分子机器之一,是介导生物大分子进行核质转运的唯一通道,参与细胞内众多重要的生命活动,其功能的紊乱能够引起包括癌症在内的多种严重的疾病。近年来,通过整合冷冻电镜技术、X射线晶体学、质谱学和人工智能等技术,NPC的三维结构正在逐步得到解析。然而,关于其核质转运的分子机制仍然是不清楚的。核糖体是NPC转运的最具代表性的生物大分子组装体之一,负责合成生命的基础物质-蛋白质分子。核糖体的生物合成涉及200多个组装因子的参与,是一个高度有序的调控过程。核糖体在成熟之前,其大小亚基的组装首先起始于核仁区域,随后在核仁和核质中经过一系列的加工过程,经由NPC转运至细胞质中完成最后的成熟。近年来,科学家们已经报道了许多核糖体前体的高分辨结构,几乎涵盖了细胞核和细胞质组装阶段的主要步骤。然而,目前仍缺乏核糖体前体在NPC核质转运过程中的关键结构,这极大地阻碍了我们对核糖体在细胞内成熟过程的理解。
5月31日,南方科技大学生命科学学院、冷冻电镜中心、清华大学生命科学学院隋森芳院士团队在国际顶尖期刊Nature上发表了题为“Nuclear export of the pre-60S particles through nuclear pore complex”的最新研究成果,该成果解析了处于NPC孔道内核糖体前体(pre-60S)的高分辨结构,展示了pre-60S通过NPC孔道过程中构象和组成变化,阐述了NPC协助pre-60S进行出核转运的分子机制,为进一步理解NPC转运生物大分子的生理功能提供了重要的理论依据。
不久前,隋森芳课题组利用冷冻电镜单颗粒技术解析了酵母NPC的结构,把酵母NPC的内环 (Inner ring,IR) 结构推进到近原子分辨率3.73埃,该工作是迄今为止酵母NPC内环的最详尽、最精确的结构模型 (Cell Research 2022)。在此工作的基础上,隋森芳课题组近期在NPC内环的孔道里捕捉到被转运生物大分子颗粒的结构信息。综合运用生物化学和冷冻电子显微学的研究手段证明,处于NPC孔道内的生物大分子颗粒是核质转运过程中的核糖体前体pre-60S,并将pre-60S的结构分辨率解析到2.64 Å(图1a-c)。通过大量的统计学分析,该结构第一次揭开pre-60S颗粒在通过NPC孔道时的行为特征。孔道中pre-60S的表面结合了迄今为止报道的几乎所有转运因子,说明pre-60S的出核转运是一个十分耗能且复杂的过程(图1c-d)。结构分析显示pre-60S在出核前后展现出明显的差异性,主要表现为:组成上展示出大量组装因子和转运因子的结合与解离;结构上在L1 stalk(L1 茎)、H38(核糖体RNA螺旋38)、ES27(核糖体RNA扩展片段27)和PTC(肽基转移酶中心)区域也呈现出剧烈的构象变化(图2)。

图1. pre-60S在NPC孔道内的结构
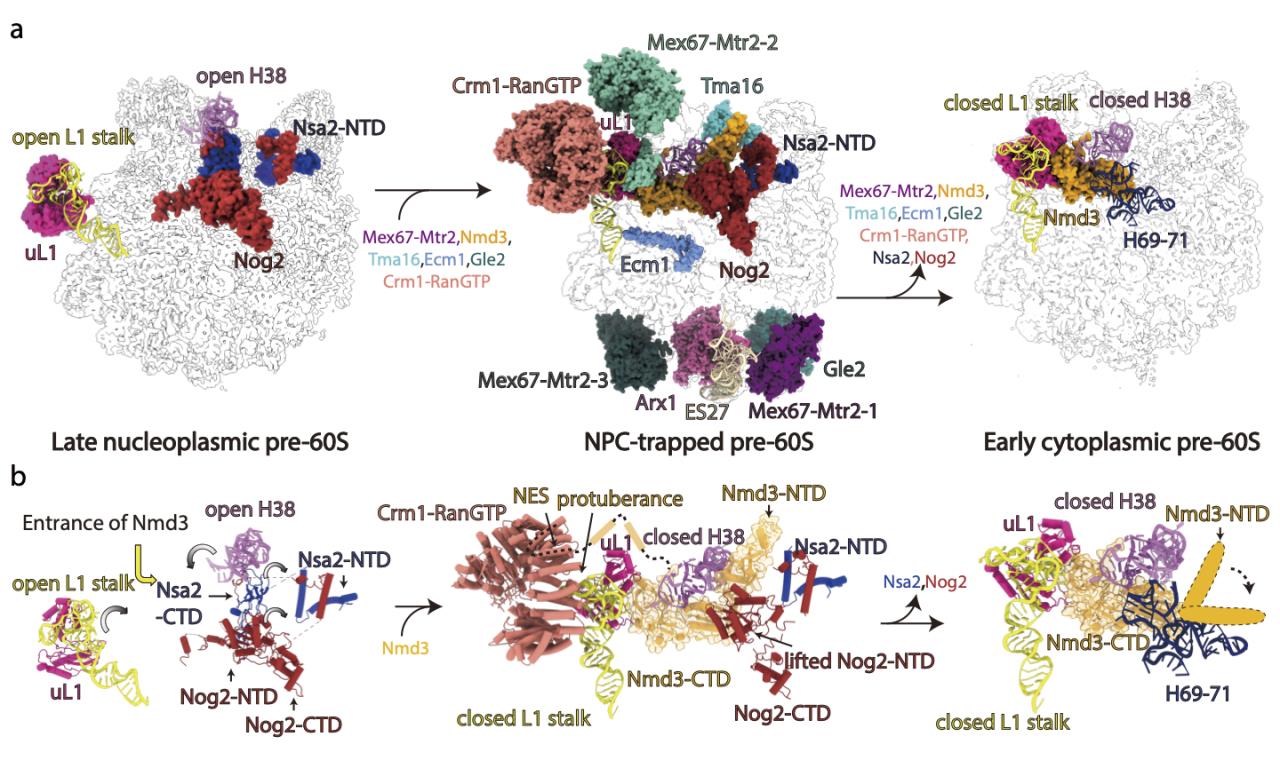
图2. pre-60S在出核转运过程中的构象变化
另外,上述转运因子主要集中在pre-60S的subunit interface(亚基互作界面),通过与NPC孔道表面FG-repeats(苯丙氨酸-甘氨酸重复片段)的联系介导了pre-60S与NPC的相互作用,并通过屏蔽rRNA表面的负电性促进pre-60S的出核转运。pre-60S及其表面结合的转运因子在NPC孔道内的分布表明pre-60S的subunit interface朝向并贴着核孔壁进行核质转运,而且IR(核孔复合物的内环)可能是该过程中的一个质量检查点。同时该研究还发现单个NPC孔道能够同时转运多个pre-60S颗粒,这种高效率的核质转运对于代谢旺盛的细胞来说也是非常必要的。基于以上研究结果,研究人员提出了关于pre-60S核质转运的模型。
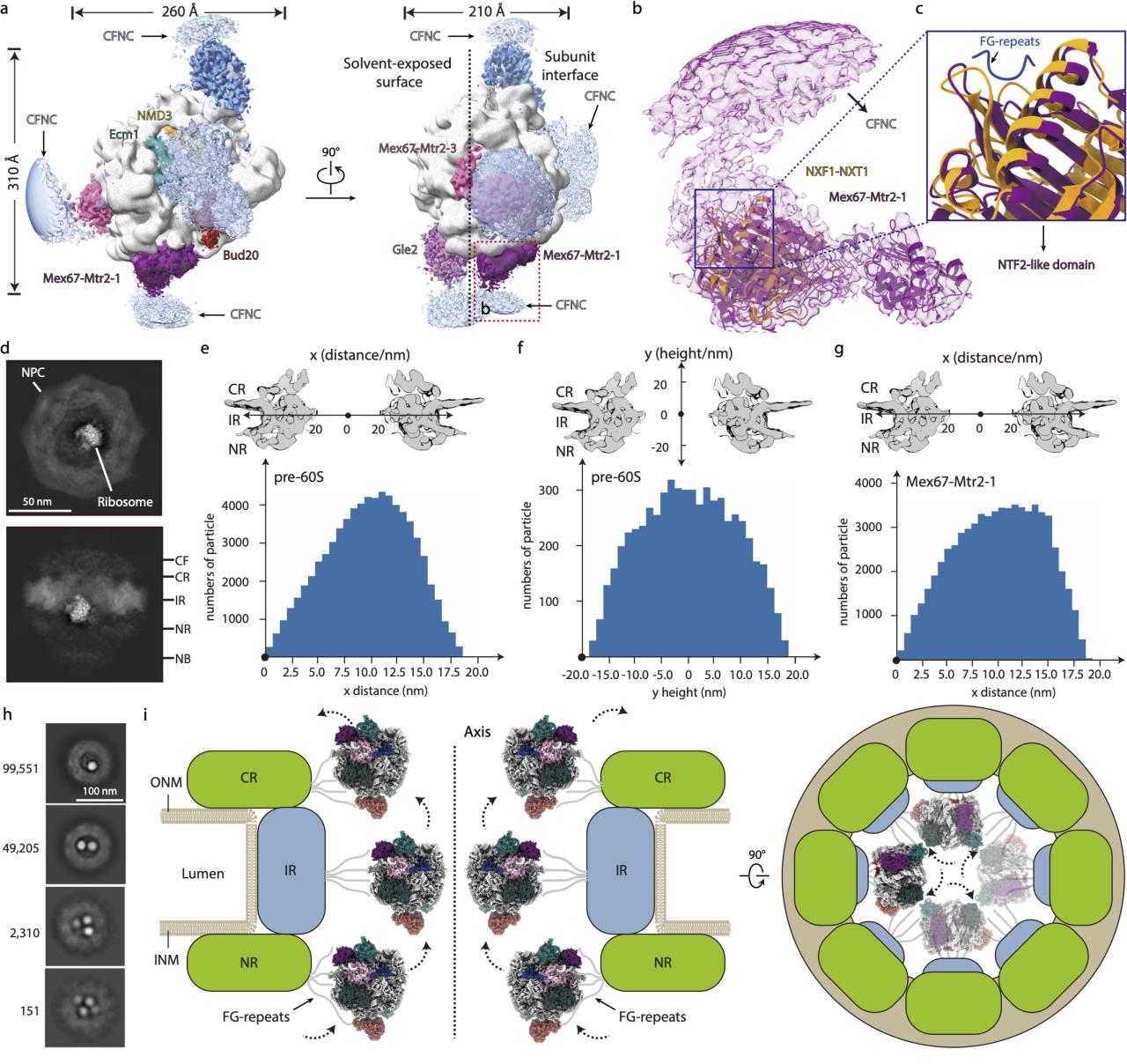
图3. pre-60S颗粒经由NPC进行出核转运的分子机制
这些研究结果为进一步完善核糖体的加工成熟、深入理解NPC核质转运的强大生理功能提供了坚实的结构基础,对核糖体和NPC两大热点、难点领域的交叉研究具有重大的促进作用,同时对理解相关疾病的发病机制以及研发相应的治疗方案和特异性药物也具有重要意义。
隋森芳院士为本文的通讯作者。南方科技大学访问学者、清华大学生命科学学院博士后李宗强和南方科技大学访问学生、清华大学生命科学学院博士生陈帅嘉彬为本文的共同第一作者。南方科技大学访问学者、清华大学生命科学学院博士后赵亮、清华大学生命科学学院博士生黄国强、南方科技大学生命科学学院博士生徐慧勤、南方科技大学生命科学学院研究助理教授杨肖云、南方科技大学冷冻电镜中心王培毅教授、北京大学生命科学学院高宁教授也参与了该研究。国家自然科学基金委、南方科技大学、膜生物学国家重点实验室、清华-北大生命科学联合中心、北京生物结构前沿研究中心等为本研究提供了经费支持。南方科技大学冷冻电镜中心为该研究相关的冷冻电镜数据收集和处理工作提供了大力支持。