生命起始于高度特化的精子和卵子的结合,从而形成具有全能性的受精卵。受精卵通过精确且复杂的转录调控,形成具有多种细胞类型的生命体。在这个过程中,增强子发挥了重要作用。增强子是基因组上一段可以和转录调控蛋白识别并结合的区域,通过与启动子作用激活转录。得益于近年来快速发展的基因组学和表观基因组学,人类和许多模式生物(比如小鼠、斑马鱼、爪蟾、线虫等)大量细胞特异的增强子图谱被绘制出来。增强子可以存在多种状态,包括预备(Primed)、待发(Poised)、激活(Active)和沉默(Silenced)。激活的增强子被转录因子结合、其组蛋白具有乙酰化修饰、染色质处于开放状态、DNA甲基化水平较低;处于预备或待发状态的增强子,缺乏组蛋白乙酰化修饰;沉默的增强子则会缺失上述大部分的表观标志。在细胞分化和发育过程中,涉及到许多增强子的激活和相应转录组的变化,这些已经有较多的综述进行总结。然而,针对增强子沉默的综述性文章还较少。
清华大学生命学院颉伟课题组于2023年5月21日在《Trends in Biochemical Sciences》期刊发表了题为“Activation, decommissioning, and dememorization: enhancers in a life cycle”的综述。该论文系统总结了在全生命周期中,增强子的激活、失活、去记忆化过程及其调控机制和生物学意义,重点回顾了领域内对增强子沉默的认知,包括增强子沉默对于细胞命运决定、胚胎发育、细胞/组织再生、亲本-合子转换的重要作用。
增强子的沉默(Enhancer silencing)包括增强子失活(Enhancer decommissioning)和增强子去记忆化(Enhancer dememorization)。其中,失活的增强子会失去转录因子的结合、丢失大部分组蛋白修饰,但是通常会保留低DNA甲基化状态。这些低DNA甲基化修饰作为“转录化石(Transcriptional fossil)”能够记录增强子曾经活跃过的信息。最终,这种低DNA甲基化的状态会在增强子去记忆化的过程中被擦除。增强子的去记忆化则通常特异地发生在亲本-合子转化期(包括配子生成和早期胚胎发育阶段),其主要目的是擦除亲本表观记忆,便于胚胎建立子代的表观图谱。随后,去记忆化的增强子进入新一轮的生命周期。
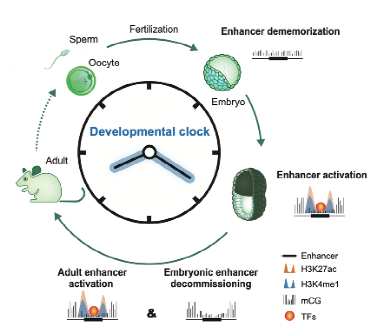
增强子在生命周期中的激活、失活与去记忆化
处于低DNA甲基化状态的增强子是具有被异常激活的风险的,那为什么失活增强子没有被重新甲基化?
有实验表明,部分失活增强子在随后的发育中会被重新启用,激活相同或不同的基因靶点。而低DNA甲基化状态可能有助于它们更好地重新启动。例如,免疫细胞中,一部分增强子在初次免疫刺激后被激活,随后保持较低水平的H3K4me1和DNA甲基化。再次免疫刺激后,这些增强子会以更快和更强的方式被激活,以帮助机体应对外来刺激。此外,在组织修复和再生、细胞重编程等过程中也有类似的失活增强子再激活的现象。值得注意的是,体细胞更容易被重编程成为来自同一胚层的细胞类型,这可能是因为在细胞重新编程过程中,低DNA甲基化的失活增强子可以更有效地被重新激活。表观基因组重编程对于将终末分化的配子转化为全能性受精卵至关重要,它能够去除配子基因组携带的亲本表观记忆并重新建立胚胎的表观基因组。在哺乳动物中,除了基因印记等特定区域外,全基因组DNA甲基化在受精后会经历广泛的擦除,亲本的增强子的DNA甲基化记忆也会被一并擦除。与哺乳动物不同,斑马鱼配子和胚胎均是高DNA甲基化状态但是,斑马鱼亲本增强子记忆依然可以被擦除。斑马鱼精子的增强子在精子成熟过程中已经被完全甲基化,而成熟卵子的增强子一开始是低甲基化的,但在受精后会逐渐甲基化。这个过程中,亲本增强子上的组蛋白乙酰化也会丢失,从而实现了斑马鱼亲本增强子去记忆化的目的。如果破坏斑马鱼早期胚胎里的DNA甲基化,很多成体发育阶段才被激活的增强子会在早期胚胎里被异常激活。因此,虽然机制有不同,增强子去记忆化这一生物学事件在斑马鱼和哺乳动物之间是保守的。
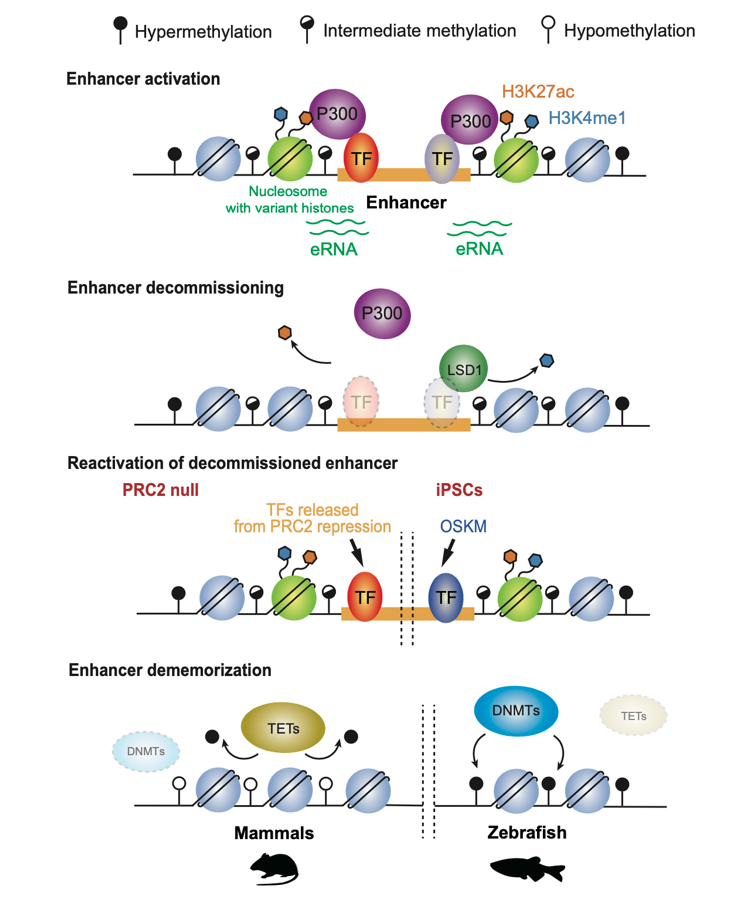
增强子激活、失活、重激活和去记忆化的调控机制
增强子的表观特征不仅反映了其过去的转录记忆,同时还保留了其未来被激活的潜力,诠释增强子沉默的调控机制能够有助于加深对细胞命运动态变化的理解。增强子的去记忆化能够确保有效地消除亲本的表观记忆,实现生命时钟的重置。在理解增强子沉默的潜在调控机制方面仍有许多工作要做。单细胞多组学方法将非常有助于描述增强子失活和去记忆的动态变化过程,并追踪这些增强子在复杂组织发育和细胞重编程过程中的活性状态。总之,对增强子生命周期的深入理解将为精确控制细胞命运,从而为再生医学提供助力。
清华大学生命学院颉伟教授为本文的通讯作者,清华大学生命学院助理研究员吴小童是此论文的第一作者,清华大学生命科学联合中心颉伟课题组2020级博士生吴希为论文的撰写提供了重要帮助。该项目获得了国家科技部重点研发计划、国家自然科学基金委、清华北大生命科学联合中心、新基石研究员以及美国霍华德休斯医学研究所国际研究学者(HHMI International Research Scholar)的支持。
原文链接: https://doi.org/10.1016/j.tibs.2023.04.005