新型冠状病毒为具有囊膜的正义单链RNA病毒,它变异速度快,短短三年内已进化出Alpha,Beta,Gamma,Delta,Omicron等多个变异株。有些突变会导致抗原漂移,增加感染性,削弱疫苗及抗体的效力,给疫情防控带来挑战。在这些重点关注的变异株中,B.1.617.2(Delta)表面的S蛋白表现出最高的膜融合特性;同时,Delta株表现出最高的致病性,且病人的平均病程最长。Delta S蛋白的超强膜融合能力已知可在仓鼠上引发更重的症状,且新冠病毒诱导产生的合胞体可能促进病毒的复制、传播、免疫逃脱,甚至组织损伤。这提示,冠状病毒S蛋白介导膜融合的能力及其与感染者肺组织损伤严重性之间可能存在联系。因此,研究Delta变异株S蛋白的原位结构和膜融合机制具有重要性。
继2020年报道了新冠病毒原始株的全病毒三维结构后,2023年4月25日,清华大学生命学院李赛团队在《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America)杂志发表了题为“新冠病毒Delta变异株的原位结构和膜融合”( In situ architecture and membrane fusion of SARS-CoV-2 Delta variant)的文章。结合冷冻电子断层成像、单颗粒分析和质谱技术,解析了新冠病毒Delta变异株的原位特征,并展示了Delta不同于原始株的结构基础。
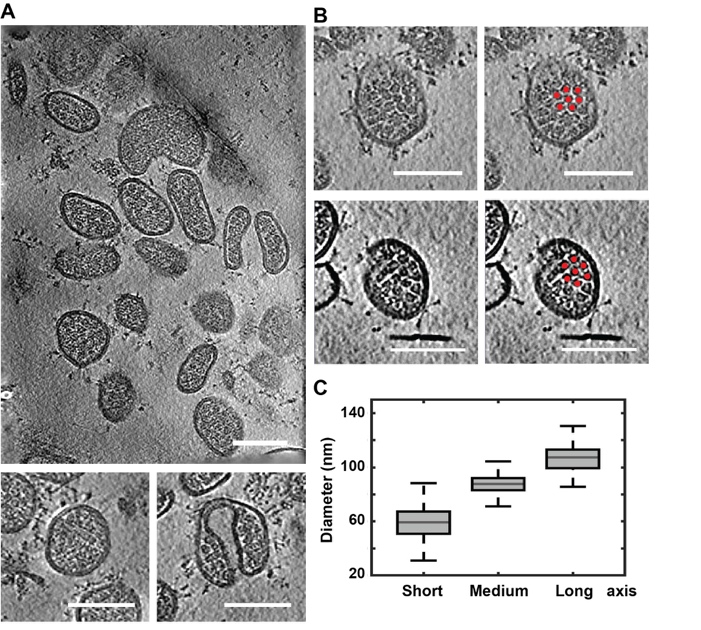
图1. 高能电子束辐照灭活的新冠病毒Delta变异株形态
第一,研究团队采用了高能电子辐照和多聚甲醛两种不同方式对新冠病毒Delta变异株进行灭活,证明Delta变异株的形态具有更大的多形性;相比原始株,囊膜更易发生形变(图1)。第二,冷冻电子断层图像数据表明,与原始株相比,Delta变异株表面的S蛋白更多,相对于囊膜的摆角分布更广,融合前状态的S蛋白中处于“1 RBD up”构象的比例更高,阐释了Delta变异株感染力强的结构基础。第三,研究团队直接在病毒表面解析了4.6 Å 的“closed”构象S蛋白原位结构并搭建原子模型(图2)。通过高分辨率质谱对Delta变异株S蛋白上多个位点的N糖基化组分进行分析,发现其高甘露糖型比例比原始株高,更有利于促进病毒和细胞之间的附着。

图2. Delta变异株S蛋白的高分辨原位结构
最后,在冷冻电子断层图像数据中捕获了病毒-病毒膜融合事件(图3),说明Delta变异株S蛋白相比于原始株S蛋白处于更不稳定的状态,这为Delta变异株在融合激活时对细胞因子的依赖性减弱提供了结构证据。
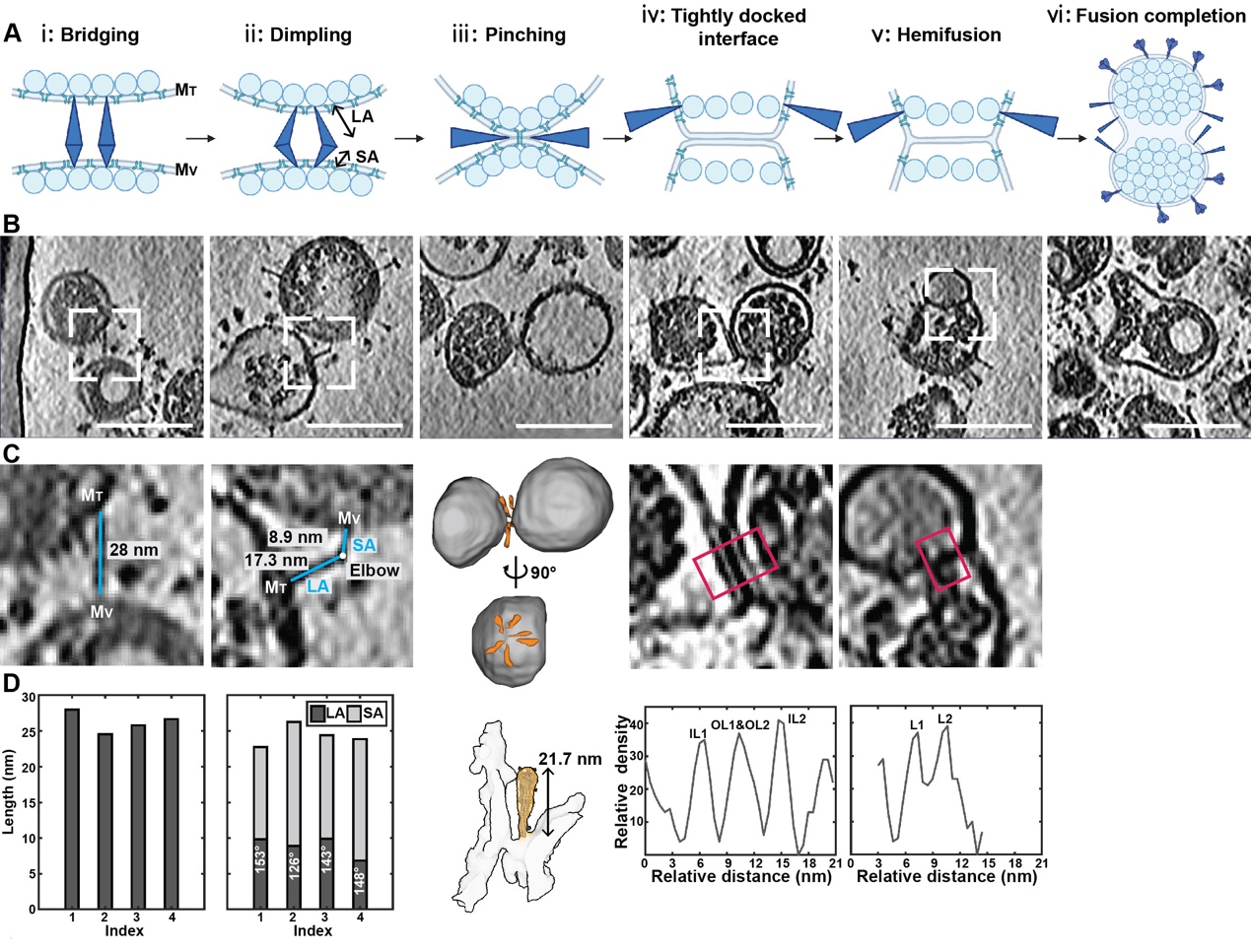
图3. S蛋白介导的新冠病毒Delta变异株膜融合过程
以上成果丰富了新冠病毒变异株的原位结构研究,在高致病性囊膜病毒灭活手段选择方面具有借鉴意义,为新冠病毒变异株相关疫苗设计及抗体药物研发提供了参考。另外,本研究直接在纯化的病毒样品中观察到新冠病毒之间发生膜融合的现象,并捕捉到S蛋白介导膜融合的中间步骤,为深入理解新冠病毒膜融合的原位机制提供了重要依据。通过比较Delta与WT毒株的结构与组装差异,该成果建立了变异株结构及致病性差异的联系。
清华大学生命学院/北京生物结构前沿研究中心/膜生物学国家重点实验室/清华-北大生命联合中心李赛副教授为本文通讯作者。清华大学生命学院2018级研究生宋雨桐,浙江大学传染病诊治国家重点实验室研究员姚航平、吴南屏,清华大学生命学院2017级博士研究生徐家璐,李赛课题组科研助理张哲源为共同第一作者。李赛课题组研究生彭程、孔维正,博士后陈勇,本科生马迪恩(Martín Echavarría Galindo),以及清华大学蛋白质化学与组学平台的赵冲冲也参与了本项工作。
本工作得到了国家蛋白质科学研究(北京)设施清华基地冷冻电镜平台,生物计算平台,蛋白质化学与组学平台的技术支持。同时,本研究得到了国家自然科学基金,清华大学春风基金,浙江省重点研发计划,国家重点研发计划等项目以及清华-北大生命联合中心、北京市结构生物学高精尖创新中心、生物结构前沿研究中心、膜生物学国家重点实验室等机构的支持。雷建林博士、杨帆博士、程凌鹏博士在冷冻电镜和结构计算方面提供了帮助,丁强教授在分子病毒学以及邓海腾教授在高分辨质谱等实验上也给予了重要指导。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2213332120