在真核细胞中,生物大分子通过相分离组装形成功能各异的无膜细胞器(MLOs),使得细胞区域化,从而实现对各种生理活动的精细时空调控。随着相分离在生命科学领域逐渐受到重视,越来越多的研究系统揭示了无膜细胞器的多种生物功能和形成机制。目前领域内仍然有很多问题亟待解决,其中最关键的是如何在体内定义相分离,以及如何建立相分离现象和生物学功能之间的逻辑关系。
细胞内的无膜细胞器景观
生命学院吝易课题组主要利用生化、细胞及神经生物学手段,建立体内外研究模型,系统性地解析细胞内无膜细胞器亚细胞结构形成的特异性以及分子机制;探索生物大分子相分离对神经系统的重要生理意义;并通过人工干预的手段调控病理状态下的异常相变,最终达到治疗神经退行性疾病的目的。
文章首先阐释了相分离的分子机制。无膜细胞器中通常富集了多种组分,其作用不尽相同,因此需要分辨哪些成分是对相分离形成和结构维持不可或缺的支架蛋白;哪些是被招募的配体蛋白。作者随后着重讨论了支架蛋白发生相分离的三种主要分子驱动力:具有良好折叠结构的串联重复结构域之间的多价相互作用、低复杂度结构域多聚组装、以及二者的共同作用。此外,目前已开发出多种基于氨基酸序列特征预测蛋白质相分离潜力的计算工具,文章也对此类工具原理与局限性进行了简要讨论。作者进一步归纳了体内与体外相分离现象相关实验中的一些注意事项:① 相分离是高度计量依赖的现象,系统临界浓度受环境因素(如温度、盐浓度、压力、pH等)的影响,因此需要尽量详细的体外和体内相图来反映在细胞中的相分离能力。并且在体外系统中,研究者应警惕使用拥挤剂(如聚乙二醇)可能带来的假象。② 为进一步观察生理状态下的无膜细胞器,应利用免疫荧光染色或内源标记等手段进行研究,并鉴定其与已知膜细胞器之间的关系。为了防止假阳性结果,需要谨慎评估抗体的特异性,以及荧光标签对蛋白质相分离能力的影响。③ 无膜细胞器具有丰富的生物物理特性,因此对其分子扩散能力、大小与形态的表征,有助于鉴别细胞内不同的相分离体系。④ 多价相互作用是相分离的基础,因此除了对相分离现象的描述外,也需剖析其中支架蛋白多价互作的分子机制。作者特别强调一个常见误区,即低复杂度结构域于相分离既非必要也非充分。
无膜细胞器通过精细的时空分布执行其生物学功能,文章对目前报道的不同功能类型进行了总结归纳:① 组成型的凝聚体稳定存在,通常参与维持基本生命活动;② 细胞信号通路中的凝聚体则具有高度动态性,接收细胞内部或外部信号后在特定位置出现并调控下游生理反应;③ 细胞应激时迅速形成或解离的凝聚体,反映出细胞对温度、pH、氧化还原和渗透状态等不利条件的适应机制。最后,文章总结了如何设计实验将相分离与其生物学功能建立关联。首先,在体内观察无膜细胞器时,应留意其出现的时序与细胞定位。为进一步剖析无膜细胞器的形成与作用机制,可以对其组分进行分析。常见的无膜细胞系分离方法包括离心、邻近标记、分选及大规模基因筛选等。此外,也可以通过如液滴共沉淀(Liquid-droplet pelleting)或水凝胶捕获(Hydrogel trapping)等体外重组技术研究无膜细胞器的组成特异性。为证明相分离对生物学功能的充要性,需要构建破坏相分离能力的突变体,利用小分子(如1,6-己二醇)解聚凝聚体,更重要的是利用分子嫁接(Molecular grafting)或光诱导系统调控相分离,建立相分离与生物功能之间的因果关系。
综上,本文系统阐释了相分离的分子机制、梳理了相分离的研究方法,探讨了如何建立相分离现象和生物学功能之间的逻辑关系,同时总结了一些相分离研究中的常见误区,希望为更多的研究人员探究生命科学中的相分离现象提供参考。
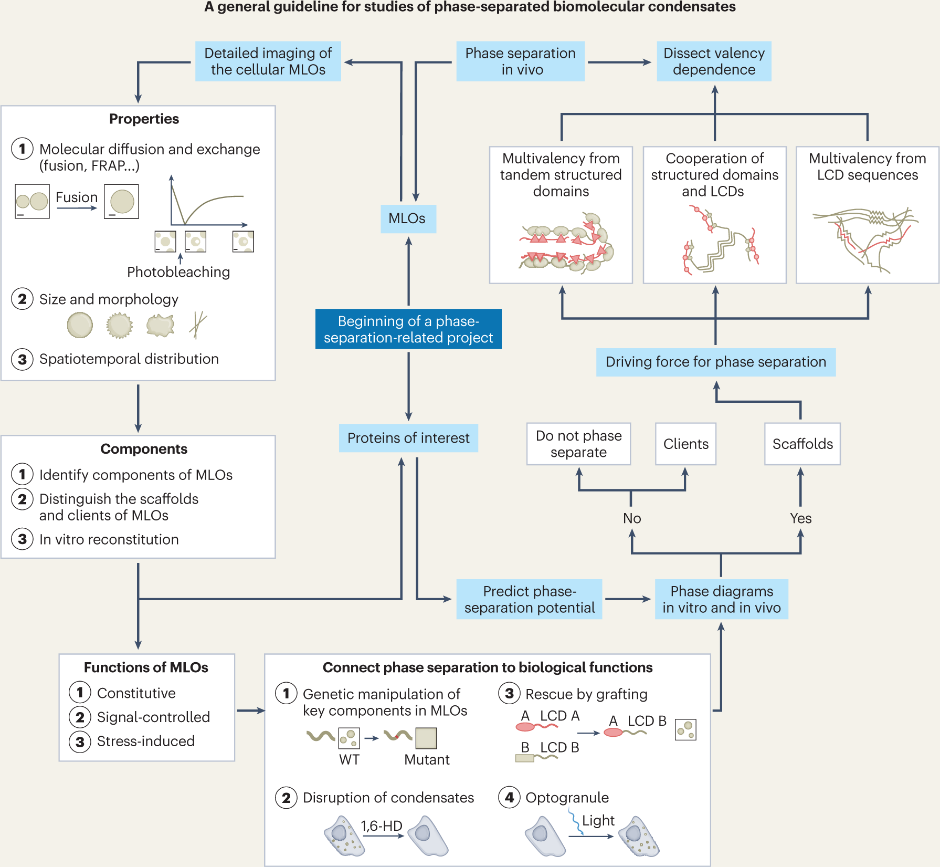
相分离研究的简要实验路线
该文章于2022年11月19日在《自然化学生物学》(Nature Chemical Biology)上以观点形式发表,题为“相分离生物分子凝聚体简要研究指南”(A brief guideline for studies of phase-separated biomolecular condensates)。清华大学生命科学学院吝易助理教授与李丕龙副教授为本文的共同通讯作者,清华大学生命科学学院2016级博士研究生郜一飞与2020级博士研究生李蹊为本文共同第一作者。两实验室分别得到清华-北大生命科学联合中心、清华-IDG/麦戈文脑科学研究院、北京结构前沿研究中心的支持。
论文链接:https://www.nature.com/articles/s41589-022-01204-2