盐碱地和干旱是我国农业生产中重要限制因素,严重威胁我国粮食安全。高盐或干旱条件下植物细胞失水引起渗透胁迫(osmotic stress),造成细胞死亡,抑制植物生长发育。植物细胞通过感知渗透压的变化,在转录、转录后或者翻译水平做出反应,从而降低胁迫带来的损害,但植物细胞感知渗透压的变化的机制尚不清楚。
液-液相分离(Liquid-Liquid phase separation, LLPS)是细胞中生物大分子通过多价相互作用,形成生物大分子聚集体(Biomolecular condensate)的重要机制。蛋白的固有无序区(Intrinsically disordered region)因其氨基酸序列低复杂性,不具有折叠的结构,是介导生物大分子间的多价相互作用的重要方式。生物大分子的LLPS对于细胞内理化环境非常敏感,如温度、pH、离子浓度、拥挤程度等会通过调节LLPS,影响生物大分子凝聚体的组装、解聚或者相转变,为细胞应对外界胁迫提供了新的方式。
生命学院方晓峰课题组主要研究植物细胞中蛋白质的相分离如何帮助细胞感知、响应和记忆非生物胁迫。研究团队通过筛选发现拟南芥转录调节蛋白SEUSS (SEU)在本氏烟草、酵母和拟南芥中均可以感应渗透胁迫变化并形成蛋白凝聚体(如图1),且这些凝聚体具有液态属性。
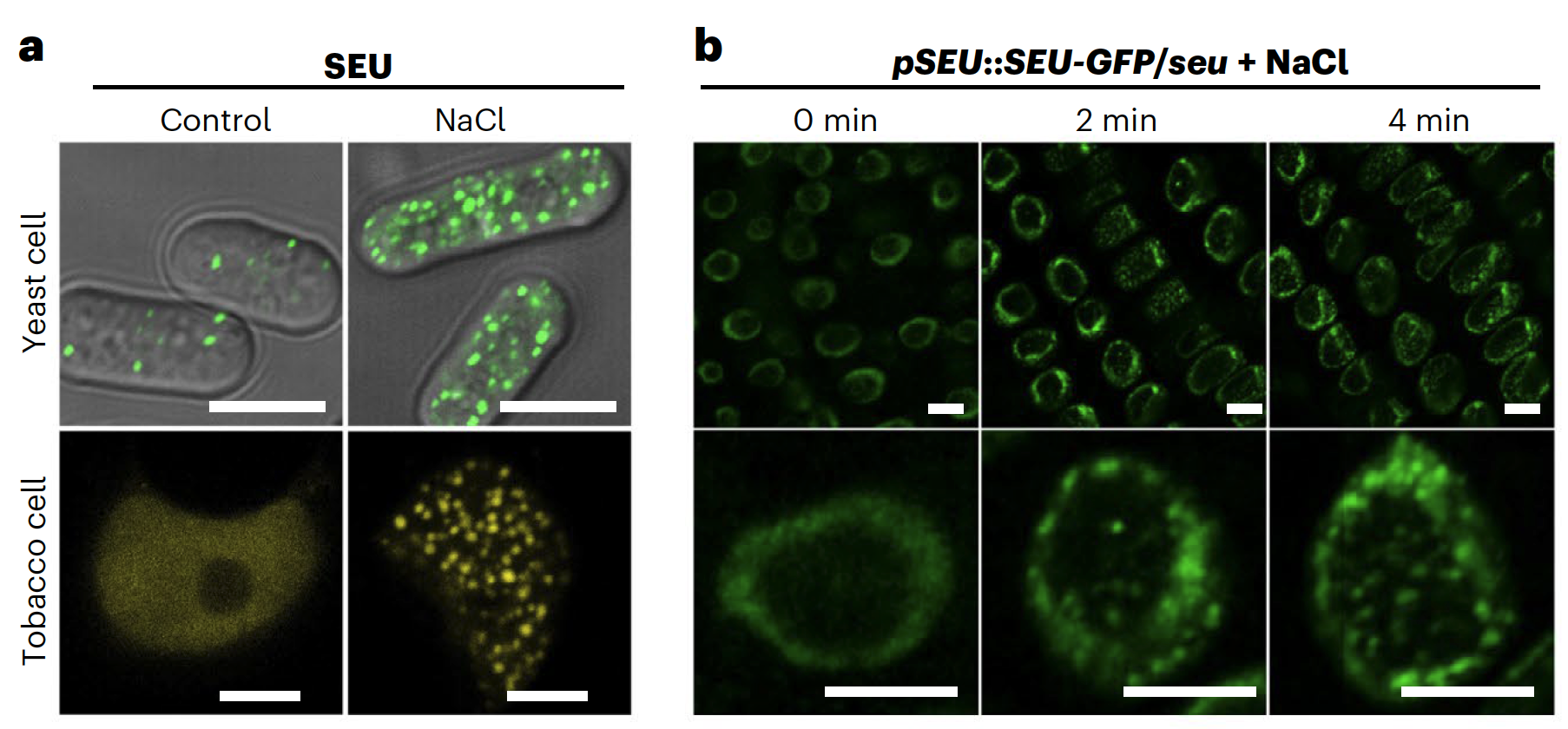
图1. SEU在高渗胁迫下发生相分离形成凝聚体
进一步研究发现,SEU的 N端IDR是其发生相分离的必要且充分条件。高渗胁迫引起细胞失水,细胞体积变小,从而引起细胞内分子拥挤程度和离子浓度升高。SEU的相分离主要由分子拥挤程度升高引发。通过预测发现SEU的IDR1中存在两个α-螺旋结构,通过其构象的改变,感受拥挤程度的变化。α-螺旋的缺失会使IDR1丧失感知分子拥挤的能力,且缺少α-螺旋的SEU蛋白不再能响应渗透胁迫形成凝聚体,因此SEU通过响应细胞内分子拥挤程度的变化,感知渗透胁迫(如图2)。
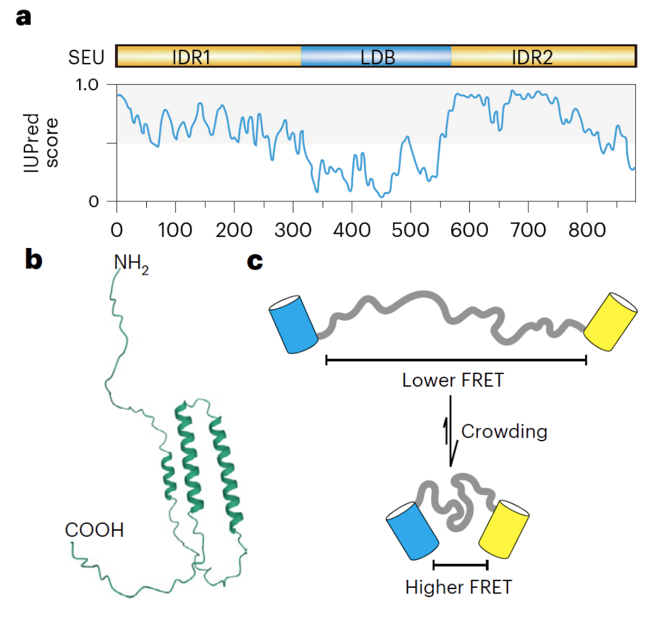
图2. SEU的相分离主要感知细胞内分子拥挤程度变
遗传证据显示,缺失SEU的突变体表现出渗透胁迫敏感表型。中国科学院植物研究所林荣呈课题组主要从事光信号转导与光合作用相关研究。课题组前期发现SEU通过调控生长素合成与信号相关靶基因的表达,进而调控幼苗生长和适应光温环境。有趣的是,不具有响应渗透发生相分离能力的SEU(去除IDR1或者去除IDR1中的α-螺旋结构)能够完全回补其突变体在正常生长条件下的生长发育表型,但不能回补突变体在渗透胁迫下的敏感表型,说明SEU通过其凝聚体正调节植物细胞对高渗胁迫的耐受。通过基因表达分析发现SEU的缺失会使包括P5CS1、RD20在内的众多渗透胁迫相关基因的表达在胁迫发生时不能有效表达(如图3)。
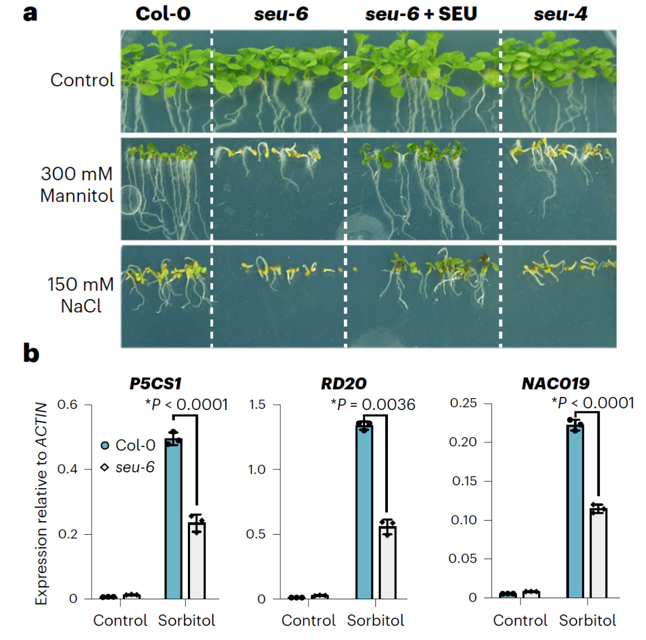
图3. SEU是植物细胞耐受渗透胁迫所必需的
综上,在正常生长状态下SEU在处于均匀分布状态,调控植物生长发育相关基因表达。当植物受到高渗胁迫时SEU利用其IDR1中的两个α-螺旋结构感知细胞内分子拥挤程度的增加,从而引起SEU蛋白的局部浓度升高,触发其相分离。SEU凝聚体可以促进渗透胁迫基因的表达而增强植物的耐逆性(如图4)。本研究揭示了植物感知和应对渗透胁迫的新机制,为研究植物抗逆提供了新思路。

图4. SEU响应渗透胁迫的工作模式图
该文章与2022年11月15日在《自然化学生物学》(Nature Chemical Biology)杂志上以长文形式发表,题为“SEUSS的凝聚体促进拟南芥对高渗胁迫的耐受”(Condensation of SEUSS promotes hyperosmotic stress tolerance in Arabidopsis)。
清华大学生命学院2020级博士研究生王博宇、博士后张红红以及中国科学院植物研究所副研究员淮俊玲为本文共同第一作者。清华大学生命学院助理教授方晓峰和中国科学院植物研究所研究员林荣呈为共同通讯作者。该工作得到了国家自然科学基金委、清华-北大生命科学联合中心以及中国科学院战略性先导科技专项基金的经费支持。
论文链接:https://www.nature.com/articles/s41589-022-01196-z