哺乳动物大脑新皮层是神经系统的最高级中枢,理解大脑新皮层的发育组装和工作机制是脑科学乃至整个自然科学的终极目标之一。研究大脑新皮层的发育及其调控机制有助于更好地理解其细胞组成和结构特性,进而推动生理功能和运行工作机制的认知,同时对相关疾病的诊断治疗有着至关重要的意义。
2022年6月20日,清华大学生命科学学院/IDG-麦戈文脑科学研究院/北京生物结构前沿研究中心/生命科学联合中心时松海课题组在《自然神经科学》 (Nature Neuroscience) 杂志在线发表了题为“乳酸代谢调控小鼠大脑新皮层血管生长和神经前体细胞行为”(Metabolic lactate production coordinates vasculature development and progenitor behavior in the developing mouse neocortex) 的研究论文。该研究从细胞代谢的角度出发,首次阐明了发育早期大脑新皮层神经前体细胞—放射状胶质前体细胞(Radial glia progenitor,RGP)—通过无氧糖酵解大量合成并分泌乳酸,刺激血管生长,并同时调节线粒体形态以维持RGP对称增殖分裂性能的崭新机制。
大脑新皮层发育是神经系统和血管系统共同发育的过程,并且二者在进程上呈现出空间和时间上的协调性。放射状胶质前体细胞(RGP)是大脑发育最为关键的一种神经前体细胞,其有序分裂产生大脑皮层几乎所有的神经元和胶质细胞。在小鼠发育早期(E10.5-E11.5),大脑新皮层中几乎没有血管生长,此时RGP主要以对称分裂进行增殖。伴随着血管的生长,RGP也随之改变其分裂方式,以不对称分裂进行神经细胞产生。尽管这一现象早已被发现,然而大脑新皮层发育过程中神经前体细胞RGP的行为与血管生长之间相互调节的内在机制依旧不清楚?
该研究基于单细胞代谢状态分析,首先观察到伴随RGP谱系发生过程的进行,RGP及其子代细胞具有不同的代谢状态。在此基础上,从基因表达、细胞代谢方式和代谢物积累三个方面展开研究,发现进行对称分裂的增殖型RGP会系统性高表达无氧糖酵解代谢相关基因和乳酸胞外转运子基因,表现出更强的无氧糖酵解代谢速率并合成和分泌大量乳酸;而进行不对称分裂的分化型RGP则选择性高表达三羧酸循环中的关键基因,表现出更强的氧化磷酸化代谢速率和乙酰辅酶A的积累。进一步研究发现在大脑新皮层发育早期,因增殖型RGP具有更强的乳酸合成和胞外分泌能力,使大脑新皮层组织内呈现高浓度乳酸微环境,促进了血管的生长。此外,乳酸代谢还可通过维持线粒体长度来增加RGP增殖性能,抑制或阻断乳酸合成代谢都会导致线粒长度变短,从而导致RGP过早分化。
该研究从细胞代谢角度出发,系统研究细胞代谢方式及相关代谢产物在调控大脑新皮层发育过程中的关键细胞活动和分子机制,为研究神经前体细胞行为和新皮层发育调控提供了全新的角度和方向,为更好的理解哺乳动物大脑发育机制提供了重要的理论补充。
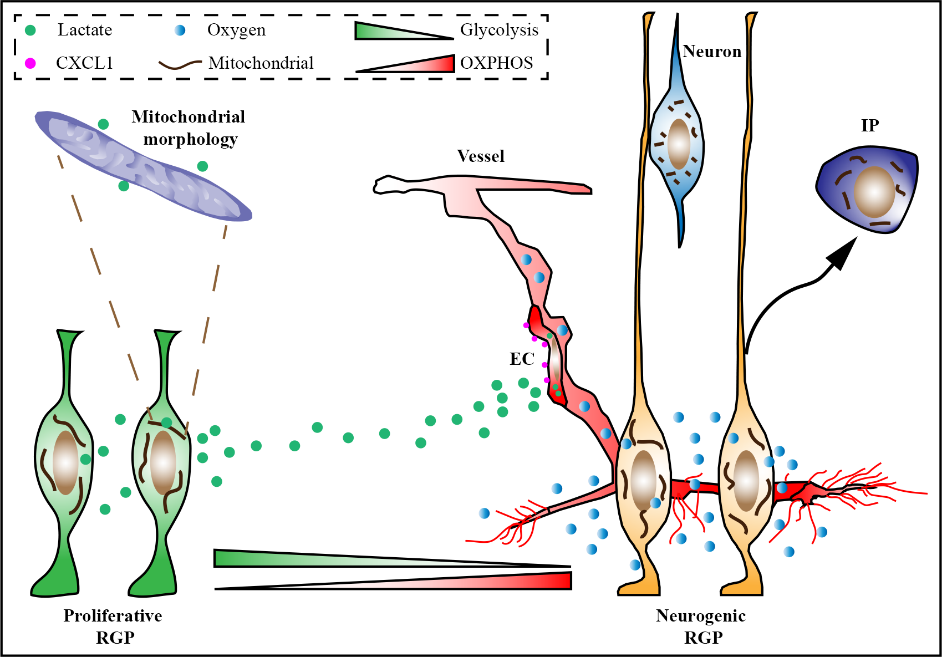
乳酸合成代谢调控大脑新皮层早期发育
清华大学生命学院时松海教授为本文的通讯作者,清华大学生命学院2017级博士研究生董晓翔为本文第一作者,清华大学生命学院张强强博士和马健博士、清华大学生命学院2018级博士研究生于翔宇和2020级博士研究生王玎,以及达特茅斯学院本科生马嘉明参与本文研究。该研究得到了清华大学实验动物中心和生物医学测试中心的大力协助和支持。该研究获得了国家自然科学基金委创新群体基金、国家科技部脑科学与类脑研究基金、北京市教育委员会卓越青年科学家计划、北京市科技委员会科技计划、北京生物结构前沿研究中心、生命科学联合中心和北京脑科学与类脑研究中心的资助。
文章链接:https://doi.org/10.1038/s41593-022-01093-7