CRISPR-Cas系统已经被广泛开发并应用于各类细胞和组织的遗传或表观遗传编辑,相关技术亦被逐步用于农业育种、人类疾病治疗及生物能源生产等方面,是未来生物科技发展的重要领域。但经过近十年的研究,仅有Cas9和Cas12a这两类酶能被用作高效的基因编辑工具。其中,常用的SpyCas9和AsCas12a蛋白分子量大,超过1300个氨基酸,极大地影响了细胞转染效率和可用于蛋白质工程编辑的自由度。另外,许多研究表明,这两个酶存在较为严重的脱靶效应,而且多种病原微生物中也存在这两类酶,这些因素都严重阻碍了CRISPR-Cas基因编辑技术的体内应用,尤其是针对人类疾病治疗相关的应用。
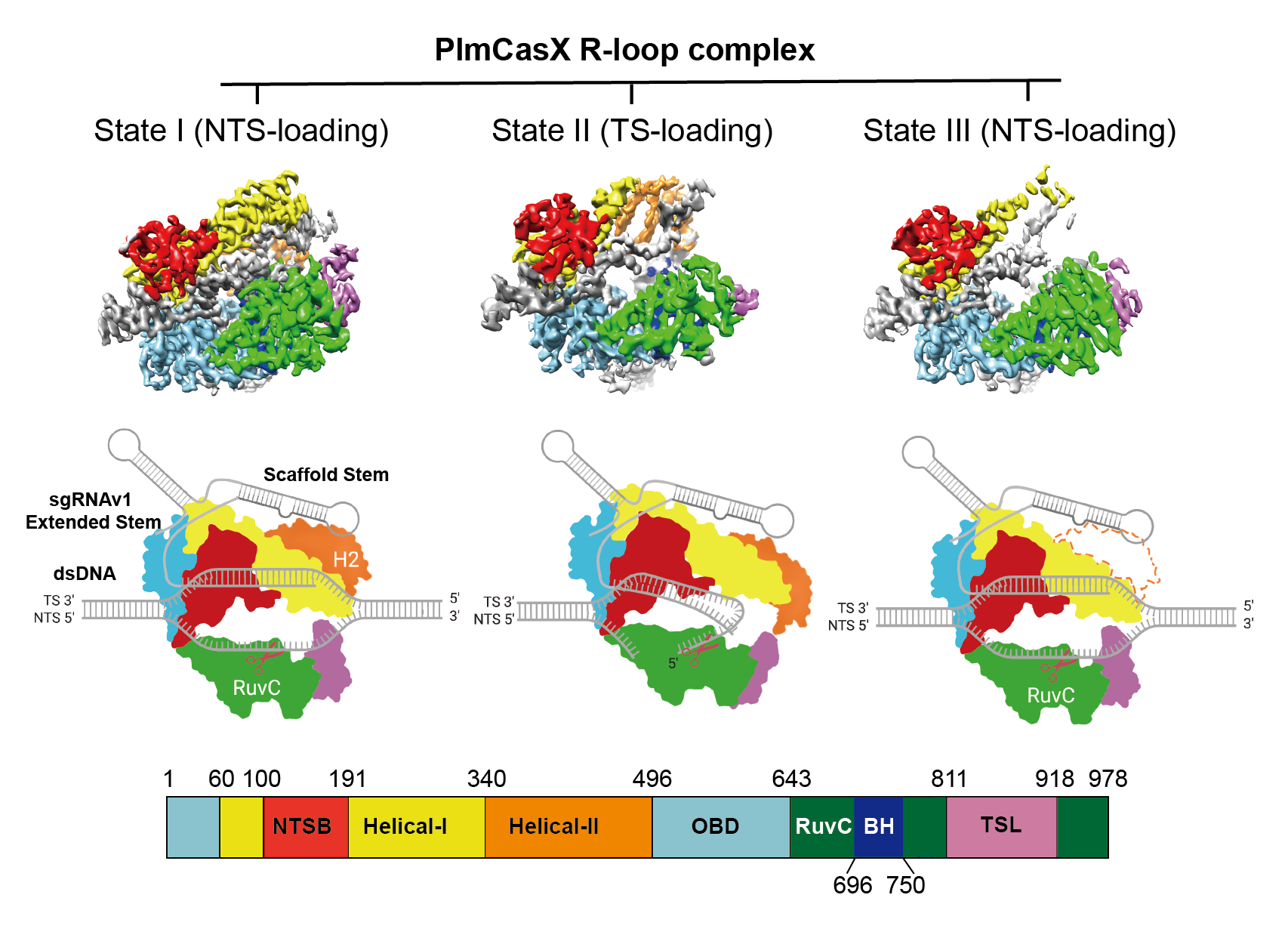
图1 PlmCasX R-loop复合物的三种结构状态
刘俊杰助理教授长期专注DNA和RNA核酸酶研究及相关核酸操纵工具的开发。2019年,刘俊杰及其合作者发现并鉴定了一类来自于非致病菌的、可用于基因编辑操作的小型(<1000个氨基酸)CRISPR-CasX核酸酶 (Liu J.J. et al., Nature, 2019)。该工作也通过对DpbCasX与gRNA及DNA底物所存在的不同结构状态的解析,揭示了CasX如何有效地协调多个结构亚基来完成基于单个酶活中心的DNA双链切割的机理,这与Cas9和Cas12a系统截然不同。然而,CasX以及近期其他课题组报道的小型基因编辑工具,如CasPhi, Cas12f 等,基因编辑效率均比较低,限制了它们的广泛应用。
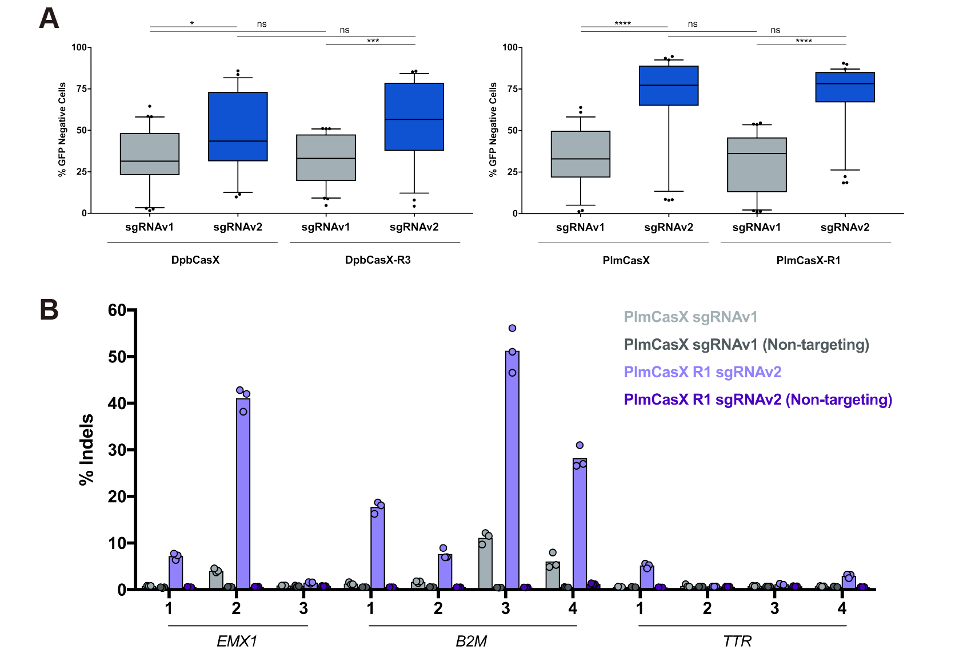
图2 改造前后的CasX基因编辑效率对比。最新的CasX基因编辑平台,可对GFP位点产生平均80%左右的编辑效率(A),对测试的内源位点可产生最高50%的编辑效率(B)
2022年2月25日,刘俊杰课题组与加州大学Jennifer Doudna课题组合作在《分子细胞》(Molecular Cell)杂志在线发表题为“嵌合的 CRISPR-CasX 酶和新型引导 RNA 可增强基因编辑活性”(Chimeric CRISPR-CasX enzymes and guide RNAs for improved genome editing activity)的研究论文。该工作通过解析PlmCasX与底物的不同结构状态,并与DpbCasX对比,解释了DpbCasX和PlmCasX各异的体内外DNA切割活性的结构基础。同时,通过对CasX蛋白和sgRNA的结构改造,极大地提高了DpbCasX和PlmCasX的基因编辑效率,在GFP位点上可达90%,在内源位点上可达50%。CasX具有分子量小(980个氨基酸)、基因编辑效率高及非特异性DNA切割活性低等众多优点,有望为基因编辑工具的临床应用提供重要技术支撑。
清华大学生命学院刘俊杰助理教授和加州大学伯克利分校Jennifer Doudna教授为本文的共同通讯作者,高精尖结构生物学中心卓越学者张寿悦、生命学院博士后赵玉倩、加州大学伯克利分校博士研究生Connor Tsuchida 和 Mohammad Saffarri Doost为本文的共同第一作者。美国劳伦斯伯克利国家实验室的Eva Nogales教授,北京大学未来技术学院陈晓伟助理教授,以色列特拉维夫大学的David Burstein助理教授、清华大学薛毅助理教授、方显扬助理教授也在该工作中给予了大力的支持和帮助。清华大学冷冻电子显微镜平台和生物医学计算平台为本课题提供了技术支持。该研究由国家自然科学基金委、清华大学春风基金和刘俊杰实验室启动经费支持。
论文链接:https://doi.org/10.1016/j.molcel.2022.02.002
阅读链接(50天内有效):https://authors.elsevier.com/a/1eeoW3vVUPK7Al