细胞极性是真核细胞的基本特征,在细胞运动、不对称细胞分裂和细胞信号传导等细胞过程中发挥关键作用。细胞极性的建立涉及不同细胞组分通过不对称组装来执行特定的功能。在细胞极化过程中,由Arp2/3复合体介导形成的分支状微丝网络以及由该网络产生的推力促进了细胞膜的重塑。微丝的连续组装必须通过解聚来平衡,确保有源源不断的肌动蛋白单体参与微丝的聚合。冠蛋白家族蛋白(coronin family protein)是保守的微丝调节蛋白,最典型的coronin蛋白是I型coronin(如Coronin1B),它通过β-螺旋桨(β-propeller)结构与微丝结合,并通过其N端与Arp2/3复合物结合,从而阻碍了Arp2/3与微丝的对接,并促进了已有的微丝网络的去分支。线虫POD-1蛋白是保守的coronin家族蛋白,作为III型coronin,其生化和细胞功能并不清楚。
2021年9月14日,清华大学生命科学院欧光朔实验室在《Proc Natl Acad Sci U S A》杂志发表了题为“微丝去分支在细胞迁移和不对称细胞分裂中调控细胞极性”( Actin filament debranching regulates cell polarity during cell migration and asymmetric cell division)的文章,报道微丝骨架去分支在细胞迁移和不对称细胞分裂中的调控作用。
欧光朔实验室通过体外的微丝聚合实验发现POD-1能够使Arp2/3介导生成的微丝网络去分支,对内源性POD-1蛋白的荧光实时成像分析结果表明 POD-1与迁移的神经前体细胞前缘的Arp2/3共定位(图1),发现POD-1在神经前体细胞中的条件性敲除导致了细胞内微丝组装、细胞极性和细胞迁移的缺陷;而POD-1在线虫早期胚胎内的敲低阻断了Arp2/3的运动,并影响了极化的皮质流(cortical flow),最终导致细胞命运决定因子的对称分离。这些结果表明,在迁移的神经前体细胞和不对称分裂的胚胎中,细胞通过微丝去分支来组织微丝网络和细胞极性(图2)。
论文的通讯作者是清华大学欧光朔教授和李薇副研究员,清华大学博士后解超是该文章的第一作者。清华大学黄善金教授实验室为本研究提供了微丝体外实验平台。本研究工作得到了清华-北大生命科学联合中心、科技部、国家自然科学基金委等相关机构的经费资助。
原文链接:https://doi.org/10.1073/pnas.2100805118
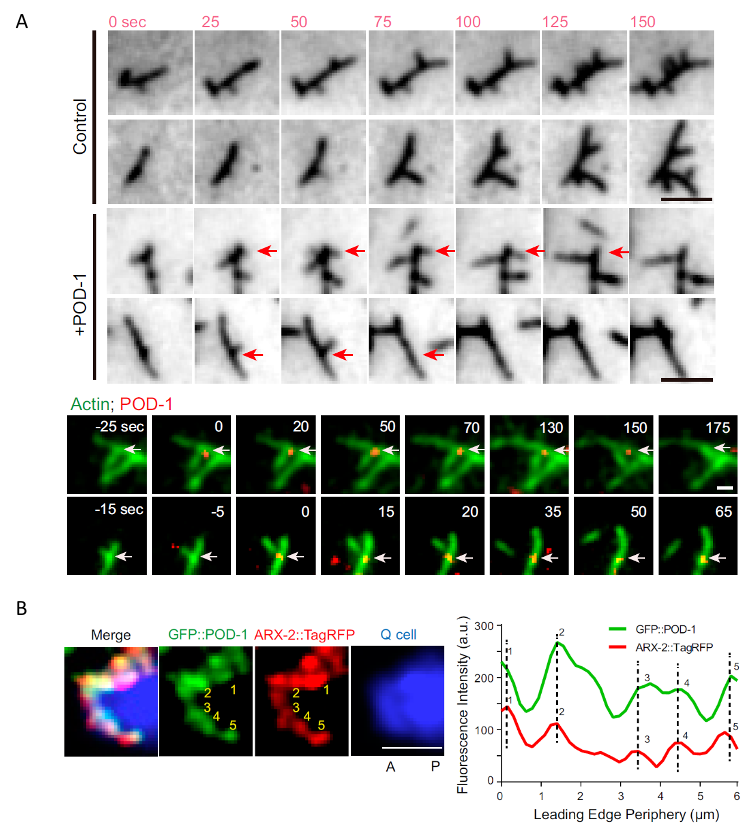
图2. 在迁移的神经前体细胞和不对称分裂的胚胎中,细胞通过微丝去分支来组织微丝网络和细胞极性
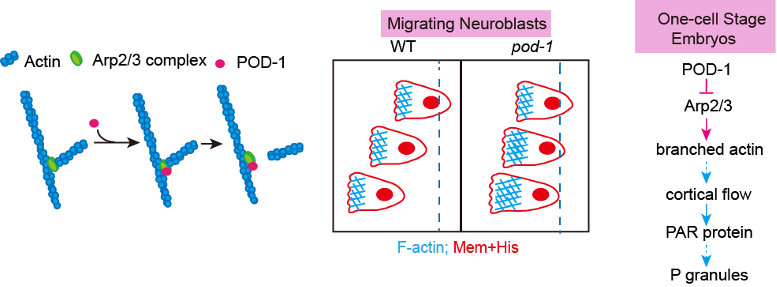
图1.POD-1在体外引起微丝骨架去分支,在体内与Arp2/3共定位