“万物生长靠太阳,果蝇飞翔靠翅膀”。振翅飞行是昆虫进化上的核心策略,赋予了其在进化上的巨大优势,这使得昆虫成为这个星球上一半以上的已知物种。昆虫的翅膀是在变态发育过程中由背侧和腹侧两层细胞通过贴合而形成的扁平附属物。1940 年代,在历史上开创了发育遗传学和表观遗传学领域的工作中,Conrad H. Waddington 描述了黑腹果蝇的翅膀发育是一个贴合-分离-再贴合的过程,并且在背腹两层细胞间存在长长的突起【1, 2】。后经过很多遗传筛选实验,我们认识到翅膀的贴合涉及到细胞外基质的粘附、基质的产生和降解以及基质-细胞骨架间的协作【3】。然而,整个翅膀贴合过程的逻辑和时间线,细胞突起的作用和胞外基质的成分仍然有待进一步研究【4】。近日,清华大学生命学院José C. Pastor-Pareja课题组在《Cell Reports》杂志上发表长文,该研究工作阐释了这些数十年之久的问题,并为研究昆虫翅膀的进化提供了新的角度【5】。
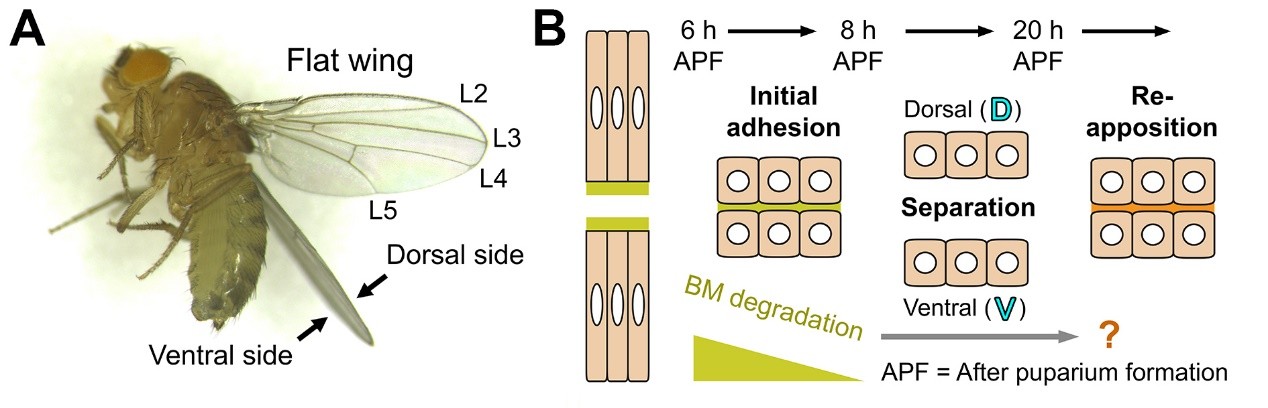
图1. (A) 野生型果蝇翅膀呈扁平状 (B) 不同发育时期下,果蝇翅膀贴合-分开-再贴合的示意图
José C. Pastor-Pareja课题组采用了一种体内成像的新方法,该方法可以在不干扰果蝇正常发育的情况下对翅膀的形态建成实现长时程成像。借助成像技术,研究人员发现翅膀背腹两层细胞的首次贴合是由于两层细胞间的基底膜组分发生降解。在结蛹后8个小时左右(8 h APF),胞外基底膜组分基本被降解,而此时维持翅膀贴合的是层粘连蛋白(Laminin)斑点,与传统的片层结构基底膜不同,这是一种不含胶原蛋白IV和其他组分的非典型细胞外基质。
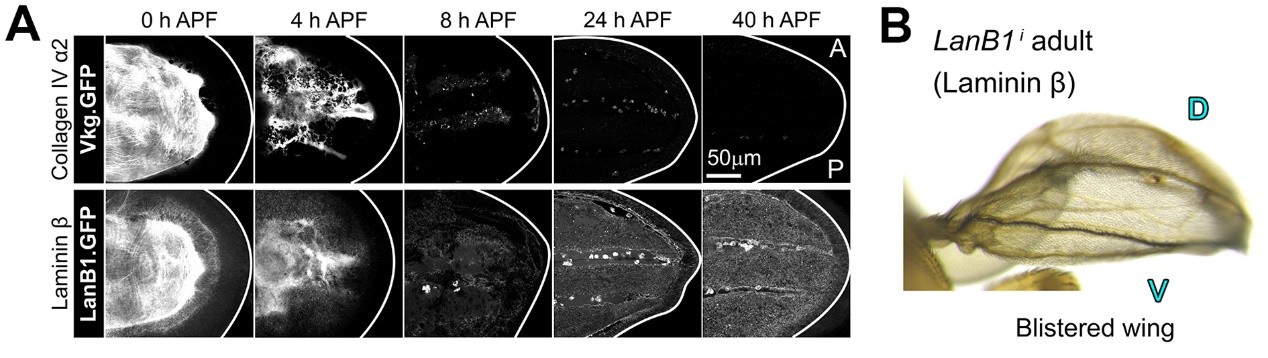
图2. (A) 层粘粘蛋白和胶原蛋白IV在翅膀发育过程中的表达情况 (B) 敲低层粘粘蛋白造成翅膀贴合缺陷 (鼓泡的翅膀)
此外,研究人员还发现果蝇的变态发育使翅膀两层细胞因内部压力而被分开,在非典型层粘粘蛋白斑点处形成长电缆般的突起连接结构,这些突起连接由细胞骨架组分微管微丝共同构成。细胞骨架突起在对抗变态发育过程中产生的内部高压这一关键时期,起到了维持背腹两层细胞接触连接的作用。翅膀发育全过程的体内成像记录了当内部压力降低时,电缆般的突起结构会解聚和收缩,这使得背腹两层细胞完成第二次也是最终的贴合。
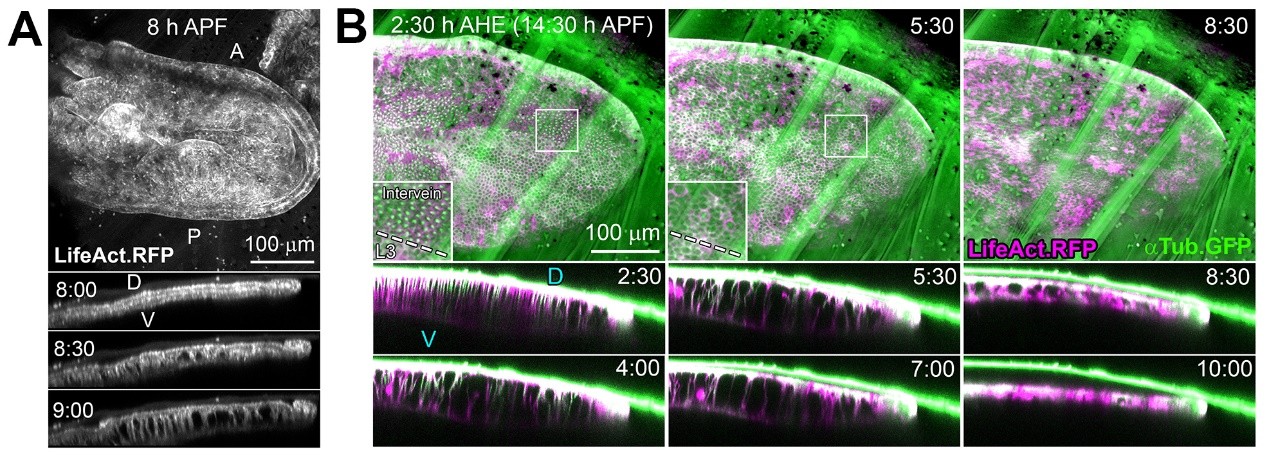
图3. (A) 细胞骨架突起的形成(结蛹后8-9小时, 8h to 9h APF) (B) 翅膀背腹两层细胞的再贴合过程(头部外翻后 2.5 小时至 10 小时,2.5 h to 10 h AHE;结蛹后14.5 小时至 22 小时,14.5 h to 22 h APF)
为了进一步研究电缆般的细胞骨架突起是如何组装和解聚的,Pastor-Pareja课题组在果蝇翅膀中开展了针对细胞骨架相关蛋白的遗传筛选实验。研究人员发现Shot、Patronin、septins和在翅膀特异表达的新蛋白Sdb(SAXO downstream of blistered)对于形成能够有效抗压的细胞骨架突起连接是必需的。研究人员采用最新的果蝇遗传和转基因技术还发现了Sdb是受到翅脉间转录因子SRF(Serum Response Factor)调控的微管稳定蛋白。此外,研究者们还在鳞翅目(蝴蝶和飞蛾)的翅膀中观察到了背腹层间相似的细胞骨架突起以及Sdb和SRF同源物在翅脉间区域特异性的表达分布。以上研究结果表明,能够产生抗压的电缆般细胞骨架是有翅昆虫在进化上的关键一步。
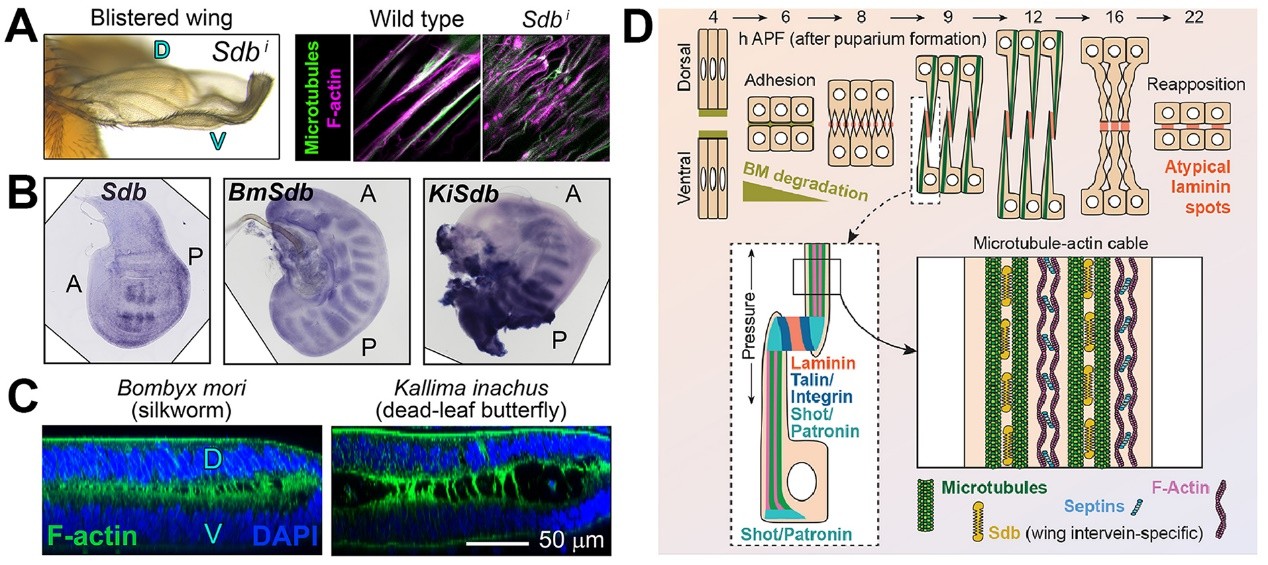
图4. (A) 微管稳定蛋白Sdb的缺失造成翅膀贴合缺陷和细胞骨架异常(Sdb, SAXO downstream of blistered) (B) 在果蝇、鳞翅目家蚕和枯叶蛱蝶幼虫翅膀中Sdb的表达分布(mRNA 原位杂交)(C) 鳞翅目翅膀中的细胞骨架突起连接 (D) 翅膀贴合过程中细胞骨架及各组分的作用
此项研究工作首次对细胞和胞外基质在翅膀贴合过程中的动态变化进行了统一的阐述,发现了非典型层粘粘蛋白在翅膀形态发生过程中的必要作用,并揭示了非典型层粘连蛋白和基质-细胞骨架的协作在翅膀贴合过程中的重要进化意义。该工作2021年9月7日在《Cell Reports》上,发表了题为:非典型层黏连蛋白斑点与拉动产生的微管-微丝束介导果蝇翅膀贴合(Atypical laminin spots and pull-generated microtubule-actin projections mediate Drosophila wing adhesion)的研究论文。清华大学生命学院José C. Pastor-Pareja研究员为本文的通讯作者,已毕业博士生孙天慧为该论文第一作者,课题组其他成员宋彧炤、陈亚男、戴建莉和马梦绮同学参与了部分研究工作。同时,该课题组与北京大学张蔚老师及其博士生滕德群合作完成了家蚕和枯叶蛱蝶的相关工作。本项研究得到了清华大学果蝇中心和生物医学测试中心的支持,受到了清华-北大生命科学联合中心和国家自然科学基金委的资助。
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01111-6
延伸阅读:
[1] The genetic control of wing development in Drosophila.
Waddington CH.
J Genet (1940) 41: 75-113.
[2] The pupal contraction as an epigenetic crisis in Drosophila.
Waddington CH.
Proc Zool Soc Lond (1942) A111: 181-188.
[3] A screen to identify Drosophila genes required for integrin-mediated adhesion.
Walsh EP, Brown NH.
Genetics (1998) 150: 791-805.
[4] Atypical basement membranes and basement membrane diversity – what is normal anyway?
Pastor-Pareja JC.
J Cell Sci (2020) 133: jcs241794.
https://doi.org/10.1242/jcs.241794
[5] Atypical laminin spots and pull-generated microtubule-actin projections mediate Drosophila wing adhesion.
Sun T, Song Y, Teng D, Chen Y, Dai J, Ma M, Zhang W, Pastor-Pareja JC.
Cell Rep (2021) 36: 109667.
https://doi.org/10.1016/j.celrep.2021.109667
José C. Pastor-Pareja实验室:
http://joselab.life.tsinghua.edu.cn