近日清华大学生命科学学院陈柱成教授课题组解析了ALC1(amplification in liver cancer1,又名CHD1L:chromodomain helicase/ATPase DNA binding protein 1-like)自抑制状态下的晶体结构,以及ALC1-核小体复合物的冷冻电镜结构,结合相应的生化实验,揭示了ALC1是如何自抑制以及如何被核小体调控的机理。
真核生物体内,遗传物质DNA缠绕组蛋白形成染色质,处于高度凝缩状态。因此, 基因组复制、DNA损伤修复和基因转录等等都受到严重阻碍,这就需要染色质重塑蛋白调控染色质的开放性。ALC1是染色质重塑家族Snf2的一个亚家族,能利用水解三磷酸腺苷(ATP)产生的能量滑动核小体的位置。跟其它的染色质重塑蛋白一样,ALC1含有两个类似DNA解旋酶的催化核心结构域(Lobe1, Lobe2)(图a),它的C末端有一个独特的Macro结构域,能识别细胞内DNA损伤引发的poly(ADP-ribose) (PAR)信号。当DNA受到损伤时,PARP1(poly(ADP-ribose) polymerase 1)被激活,催化形成PAR链。ALC1能够识别这种信号,进而被招募到DNA损伤位点,滑动核小体,打开染色质结构,促进DNA的修复。ALC1是一个癌基因,在超过50 %的肝癌病例中都有高水平表达,同时过表达ALC1蛋白的细胞会使裸鼠成瘤,它的高水平表达会显著降低结肠癌患者的术后生存率。这些研究表明ALC1是治疗相关癌症非常有希望的靶点。尽管ALC1在DNA损伤修复和癌症治疗上的重要性,但它的结构以及活性调控机制并不清楚。
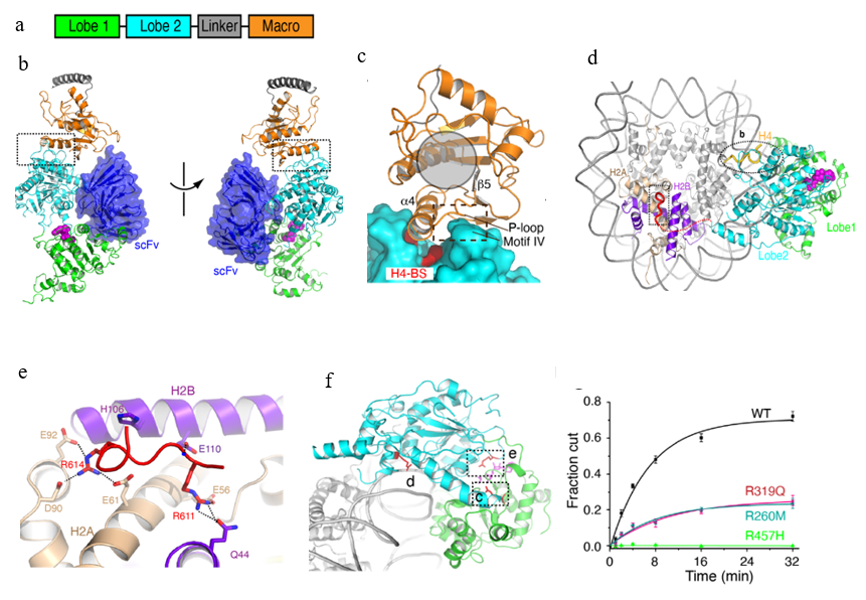
ALC1自抑制状态下呈现出非常松散的构象,对其结构研究是一个挑战和难题。早在2017年有两个课题组发现了ALC1自抑制状态,并根据质谱,X-射线小角散射等手段给出两种可能的低分辩结构模型,但ALC1的结构究竟是怎样的目前并不清楚。为了解析ALC1的结构,陈柱成课题组对ALC1蛋白进行晶体学和冷冻电子显微镜学研究。但由于蛋白的构象太多,一直无法直接获得一个高分辨的结构模型。为了稳定ALC1构型,他们筛选酵母展示库,得到了可以跟ALC1结合的单链抗体(scFv:single-chain antibody fragment/ single-chain variable fragment),并最终解析了ALC1-scFv的3.5 Å的晶体结构(图b)。
晶体结构与复合物的电镜结构图以及相关功能的研究
a. ALC1的结构域组成 b. ALC1自抑制状态下的晶体结构 c. Lobe2 与Macro 结构域的相互作用界面 d. ALC1与核小体复合物的电镜结构 e. ALC1与核小体酸性区的结合,红色部分是结构中看到的ALC1上的一段loop f. ALC1结构上与癌症相关的多个突变,以及突变对ALC1自身活性的影响
结构显示ALC1的两个催化核心之间仅由一段loop连接,并没有直接的相互作用,这解释了整个蛋白非常松散的原因。ACL1自抑制主要因为其中一个催化核心(Lobe2)与ALC1特异的Macro结构域结合(图c),抑制催化中心的功能,确保其在没有接受到DNA损伤信号时不会消耗ATP的能量,不会扰乱染色质结构。这个抑制作用可以通过Macro结构域 结合PAR链打破,也可能因为癌症相关的基因突变打破。为了得到ALC1激活状态下的机制,陈柱成课题组解析了ALC1与核小体复合物的电镜结构 (图d)。结构显示,ALC1除了与核小体DNA和H4尾巴相互作用外,也受到H2A-H2B酸性区的调控(图e),这是首次在结构中看到染色质重塑催化亚基与核小体酸性区的结合。结构和生化分析显示癌症相关的突变在多方面影响了ALC1的功能(图f),本文的研究为以ALC1为靶点设计抗癌药物提供了很好的结构基础。
该研究工作在《自然-通讯》(Nature Communication)杂志上发表,题为 《ALC1/CHD1L自抑制以及被核小体激活的结构基础》(Structural basis of ALC1/CHD1L autoinhibition and the mechanism of activation by the nucleosome)。该文章是陈柱成研究组关于染色质重塑系列工作的一个重要组成部分。清华大学生命科学学院2017级博士生王丽和2017级博士生陈康净为论文的共同第一作者,陈柱成教授为通讯作者。该研究得到国家自然科学基金委、科技部、北京市高精尖结构生物学中心项目的经费支持,以及清华大学X-射线晶体平台和上海同步辐射光源中心以及清华大学电镜平台的工作支持。
原文链接:
https://www.nature.com/articles/s41467-021-24320-4