MicroRNA在神经系统发育和功能调节中发挥着重要作用,是其正常运转不可或缺的一部分。其中miR-218,作为一个在中枢神经系统中广泛表达的miRNA,被发现在阿兹海默症、精神分裂症和抑郁症等多种神经退行性疾病和神经精神疾病中出现表达异常。在这些疾病中,患者的认知功能具有不同程度的缺陷。然而,关于miR-218在这些疾病中扮演何种角色目前仍不得而知。
在本研究中,作者通过CRISPR/Cas9技术构建miR-218-1和miR-218-2基因敲除小鼠,揭示了miR-218在大脑中广泛表达,尤其是在海马中表达水平最高;而敲除miR-218-2基因后,miR-218在海马中表达水平显著下降。随后,通过条件恐惧实验、水迷宫和T迷宫行为学测试发现,miR-218-2基因敲除小鼠的认知能力出现明显缺陷。此外,在小鼠海马区通过病毒注射过表达miR-218则会使小鼠在行为学测试中展现出增强的认知功能。
为搞清miR-218-2基因敲除小鼠认知缺陷的分子机制,作者利用全细胞膜片钳技术、高尔基染色和冷冻电镜技术分析miR-218-2基因敲除神经元的发育、形态和电生理特征,发现miR-218-2敲除的海马神经元中兴奋性突触的突触囊泡释放减少,作为学习记忆分子基础的长时程增强(LTP)减弱;miR-218-2缺失神经元的树突总长度和分支数减少,突触密度上升;并且,电镜分析结果显示,miR-218-2敲除神经元中突触囊泡的转运分布出现缺陷。此外,过表达miR-218则会导致相反的神经元表型。
进一步,作者结合RNAseq和miR-218靶基因预测数据并进行KEGG分析,筛选出可能的miR-218靶基因。利用qRT-PCR和双荧光素酶报告基因分析,确认了补体因子C3、Mmp13和Gdnf这三个基因为miR-218候选靶基因。经电生理实验验证,发现只有C3敲低的神经元表型与miR-218过表达神经元完全一致。直接使用C3蛋白多肽处理野生型小鼠可以模拟miR-218-2基因敲除小鼠的行为和细胞表型,而使用C3a受体拮抗剂SB290157处理miR-218-2基因敲除小鼠则可以挽救miR-218-2基因敲除小鼠的突触功能和认知缺陷。因此,作者得出结论,补体因子C3是miR-218调节突触功能的主要靶基因。
综上所述,miR-218-2基因在小鼠海马中通过靶基因C3调节神经元的形态和突触囊泡的转运与释放,进而影响神经元的突触可逆性和LTP的发生,最终影响小鼠的认知功能。该研究揭示了的神经退行性疾病和神经精神疾病可能通过共通的miR-218相关机制产生认知障碍,为后续的疾病认知缺陷的治疗提供了新的思路和方向。
此项研究的论文题为“miR-218-2通过C3依赖的方式调节海马体认知功能“(miR-218-2 regulates cognitive functions in the hippocampus through complement component 3-dependent modulation of synaptic vesicle release),于2021年3月29日在线发表于《美国科学院院刊》(PNAS)杂志。清华大学生命学院姚骏研究员为本文的通讯作者。生命学院博士生卢思瑶为本文的第一作者。清华大学生命学院博士后沈伟、王秋文、陈艳芬,博士生付崇雷、陈运、刘要南,中科院北京基因组所米双利研究员、博士生梁良和北京航天航空大学史微研究员为本研究做出了重要贡献。
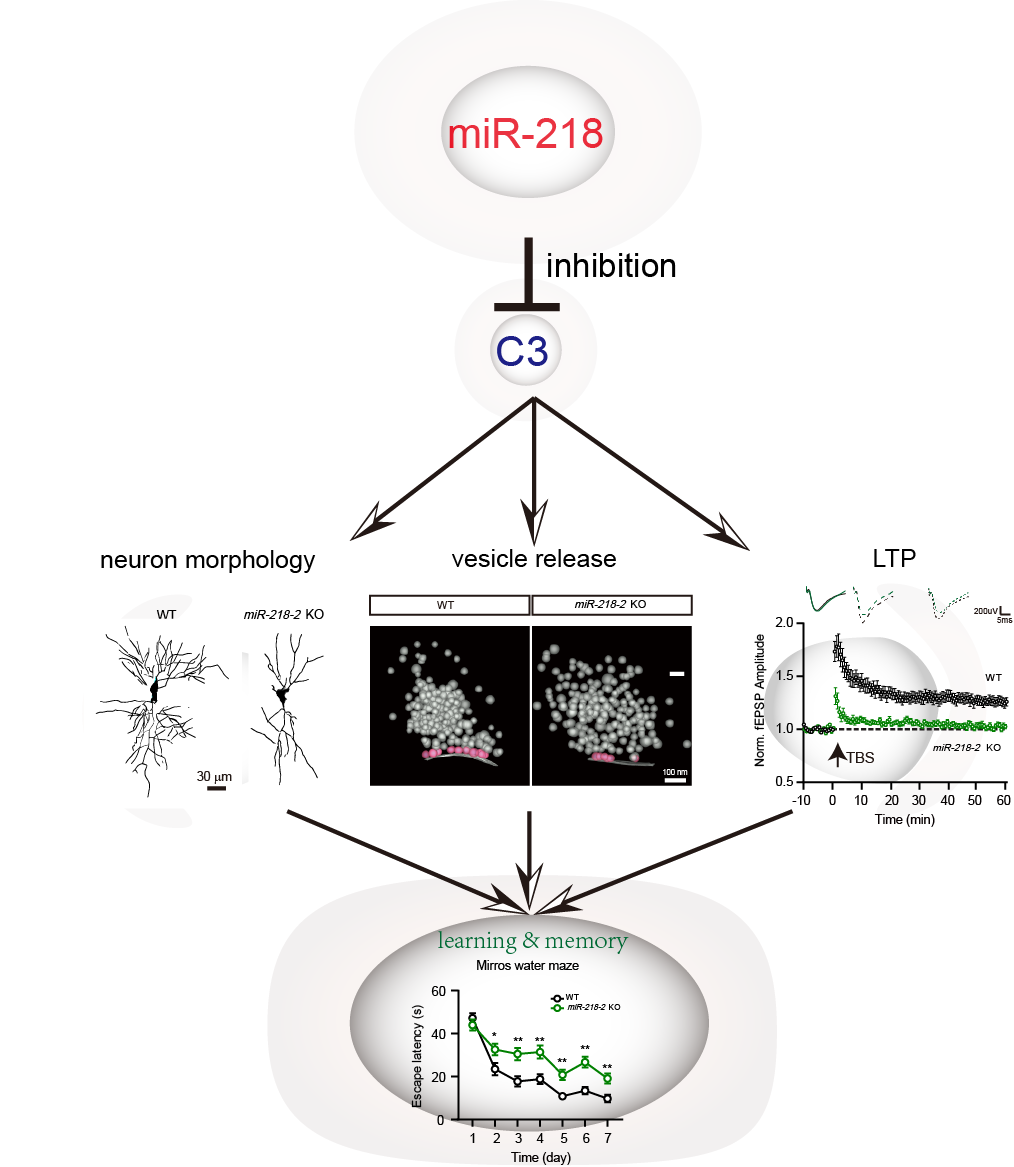
图一:miR-218通过C3调节海马认知功能
论文链接:https://www.pnas.org/content/118/14/e2021770118