● 亮点导读
1. 冷冻电镜断层成像及子断层图像平均重构技术首次从内到外地揭示了真实新型冠状病毒的全病毒三维结构。该结构将在电子显微镜数据库公开,对疫苗及抗体研发、疫情防控宣传、科普教育、分子动力学模拟等具有十分重要作用。
2. 原位解析了新型冠状病毒表面刺突蛋白的天然构像和分布,对疫苗研制及抗病毒药物研发具有重要科学意义。
3. 通过质谱分析了病毒刺突蛋白的原位糖基化组成,对灭活病毒疫苗或是体外重组疫苗的研发以及抗体治疗具有重要的指导意义。
4.开创性地揭示了新冠病毒核糖核蛋白复合物RNP的天然结构及其分子组装机制。
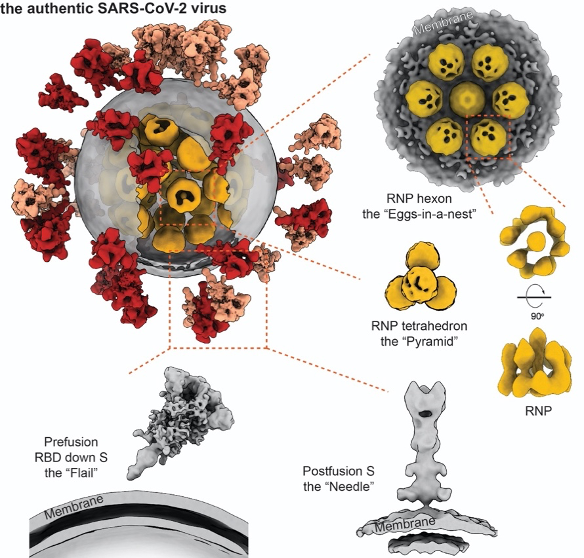
全球首次从内到外完整揭示新冠病毒全病毒精细结构
截止9月15日,新冠肺炎“大流行”已在全球造成近3千万人感染,近百万人死亡,给全球经济、人民生活等各方面造成巨大影响。然而,引发疫情的罪魁祸首新型冠状病毒,却仍然是个“看不见的敌人”。看不见,便缺少畏惧。这也许是在全球众多疫情高发区,人员仍然集会、参加派对的原因。只有获得新冠病毒的真实模样,才能警醒公众意识,促进疫情防控。抗击新冠疫情,开发疫苗及抗体等治疗手段,更离不开对病毒结构的了解。
近日,清华大学生命学院李赛研究员课题组和浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟院士课题组紧密合作,利用冷冻电镜断层成像和子断层平均重构技术成功解析了新冠病毒(SARS-CoV-2)全病毒三维结构,这一重要研究成果于北京时间2020年9月15日以 “新冠病毒的全分子结构”(Molecular architecture of the SARS-CoV-2 virus)为题在国际权威学术期刊《细胞》杂志上在线发表。

首次解析新冠全病毒分子结构
这项研究首次解析了新冠病毒全病毒的高分辨率分子结构,使世界对新冠病毒的认识更近一步,为抗击疫情、治疗新冠肺炎打下坚实全面的结构基础。在这项研究中,浙大团队提供了经严格灭活、含有新冠病毒的细胞培养液,保证了样品的天然结构。清华团队在二级实验室提纯浓缩病毒后,使用实验室开发的高通量、高分辨冷冻电镜断层成像技术(cryo-ET),采集了100TB数据、筛选出2294颗病毒颗粒(目前已知的关于新冠病毒最大的cryo-ET数据集),并重构出一颗具有代表性的完整的病毒三维结构,分辨率达7.8-11Å。统计结果表明,新冠病毒囊膜平均直径约80纳米,表面约有30个刺突蛋白,内部约有30个核糖核蛋白复合物。
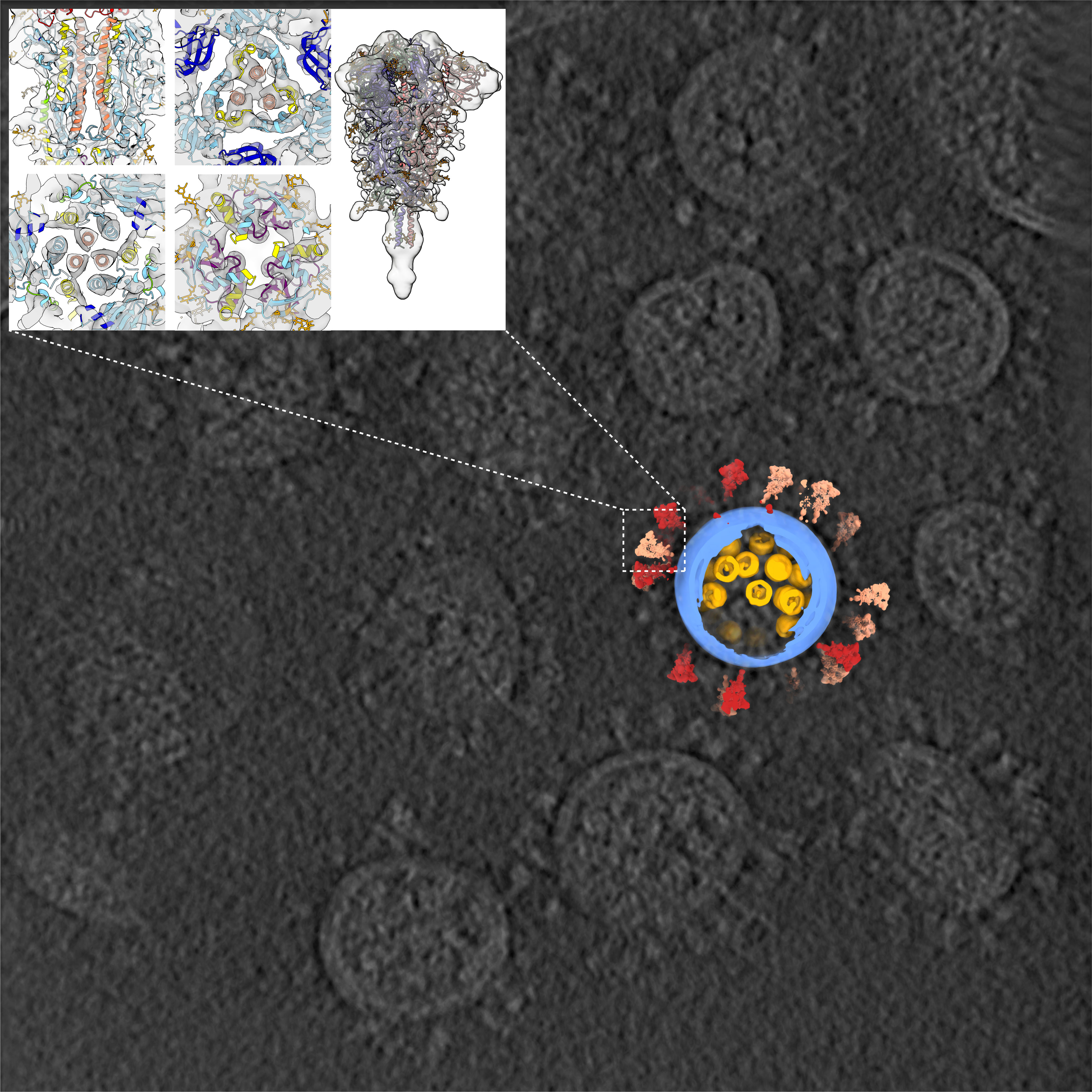
新冠病毒结构及冷冻电镜断层图像
原位状态下深度分析刺突蛋白结构
新冠病毒的“皇冠”特征,来源于它表面的刺突蛋白,凸起于病毒表面,是其侵入人体细胞的“钥匙”,目前大多数疫苗和抗体的研发均聚焦于该蛋白。
该研究解析出处于融合前状态及融合后状态的三种不同构象刺突蛋白结构。结果表明,刺突蛋白在病毒表面呈随机分布,且可自由摆动,类似于古代武器“链锤”,这种灵活的特性有利于“钥匙”及时调整方向,同细胞上更多的“锁”(受体)结合而增加侵染细胞几率。刺突蛋白也很脆弱,灭活和提纯方式不当可能导致其部分、甚至完全脱落,产生不正常的“秃”病毒。
刺突蛋白表面有多达66个糖基化修饰,这些糖像盾牌一样保护病毒不被免疫识别。此前未有对病毒上天然状态下糖基化修饰的详细研究。在清华大学蛋白质化学与组学平台的帮助下,该问题得到详细解答:相比于重组刺突蛋白,原位的糖基更大也更复杂,但总体而言相似性较大,这种相似性保证了重组刺突蛋白研发疫苗工作的有效性。
开创性揭示核糖核蛋白复合物天然结构
新冠病毒的所有遗传信息都编码在其核糖核酸(RNA)上。病毒想要“繁衍”下一代,就必须保护好这根“生命之源”。冠状病毒的RNA是所有已知RNA病毒中最长的,其直线长度可达自身直径的100倍。如何把这根核酸“长绳”完整有序地缠绕进仅有数十纳米直径的体内,是所有病毒都要费劲儿解决的几何难题。这个重任主要落在核蛋白上,它像线轴一样收纳RNA,将其有序缠绕,并组装成称为核糖核蛋白复合物(RNP)的高级结构,才能将RNA完整塞进体内。在病毒发生膜融合及去组装后,它又能有条不紊的释放RNA。这个包装方法及过程,不仅对于新冠病毒是个未解之谜,甚至在所有正义单链RNA病毒中也是几何谜题。
李赛课题组对病毒内近30000颗RNP进行了挑选和分析,开创性地展示了病毒腔内核糖核蛋白复合物结构及组装机制。该复合物像串珠一样将RNA组织在一起,并在病毒体内呈现六聚“鸟巢”型和正四面体“金字塔”型两种局部排列,有序地收纳了RNA这根“长绳”,还增加了病毒在复杂环境中经受物理挑战的能力。这是世界范围内首次“看清”正义单链RNA病毒的内部结构。
学界及社会反馈
这一真实的病毒三维图像让“看不见的敌人”清晰地展现在世人面前,首次让世界看到新冠病毒全病毒结构。这一成果对疫苗及抗体研发、疫情防控宣传、科普教育等均有重要意义。其中一位审稿人在评审意见里称赞道:“这项工作展示了迄今为止我所见过的最完整新冠病毒形象,这也是使用冷冻电镜断层成像方法解析完整颗粒结构的一次绝妙的应用……”。法国科学院院士、著名结构病毒学家Felix A.Rey教授来信祝贺道:“这是一个里程碑式的工作”。成果公开以来,被国内多家主要媒体报道,截止9月16日,阅读量近9000万,一度排名当日微博热搜前十名。并受到包括纽约时报、BBC、CellPress细胞出版社新闻部在内的众多国外媒体及记者咨询,希望获得关于该全病毒结构的更多信息。
李赛课题组
李赛研究员课题组从2018年建立至今才短短两年,能在三个月内完成这一世界级重大成果,得益于合作者李兰娟院士团队高质量的样品供应,也源自他十多年如一日坚持在囊膜病毒研究领域,并深耕于冷冻电镜断层成像技术的开发,是国内难得的既熟悉囊膜病毒,又拥有先进冷冻电镜断层成像技术的青年科学家。疫情攻关期间,他亲自带学生做实验、解结构,推进项目迅速完成。他常教育自己的学生:作为病毒科研工作者,既要有在太平时期‘甘坐冷板凳’的决心,也要有在重大疫情期间挺身而出的勇气!
李赛研究员(清华大学)为本文的第一通讯作者(lead contact),李兰娟院士(浙江大学)为本文的共同通讯作者。姚航平(浙江大学)、宋雨桐(清华大学博士生)、陈勇(清华大学博士后)、吴南屏(浙江大学)、徐家璐(清华大学博士生)为并列第一作者。另外,李赛课题组的孙楚杰,张佳星,张哲源也参与了该工作。同时,该项工作得到了多位结构及病毒学专家的大力协助,包括清华大学施一公院士、英国南安普顿大学Max Crispin教授、清华大学雷建林博士。项目的顺利开展,离不开王宏伟教授、颜宁教授、王新泉教授、张林琦教授、丁强教授、李雪明教授的支持和讨论。特别感谢清华大学冷冻电镜平台,生物计算平台,蛋白质化学与组学平台的支持。研究工作得到了清华大学人才启动经费,北京高精尖结构生物学创新中心,清华-北大生命联合中心的支持。

李赛课题组新冠课题攻关团队合影
9月16日,李赛参与法国巴斯德所的汉塔病毒结构工作也在Cell上线
值得一提的是,在新冠文章上线的第二天,李赛参与的另外一个新发型致病囊膜病毒结构工作也在Cell上线。该工作结合X-射线晶体学及冷冻电镜断层成像技术解析多个晶体结构及病毒原位结构,开创性的构建了汉塔病毒刺突蛋白包括胞外段和跨膜区的近全长结构。李赛指导博士生、并亲自参与了部分电镜样品制备、数据采集及结构计算工作。这一重要研究成果于北京时间2020年9月16日以 “汉塔病毒表面糖蛋白网格及其膜融合受控机制”(The Hantavirus Surface Glycoprotein Lattice and Its Fusion Control Mechanism)为题在国际权威学术期刊《细胞》杂志上在线发表。
新冠病毒文章链接及DOI:
https://www.cell.com/cell/fulltext/S0092-8674(20)31159-4
https://doi.org/10.1016/j.cell.2020.09.018
汉塔病毒文章链接及DOI:
https://www.cell.com/cell/fulltext/S0092-8674(20)31064-3
https://doi.org/10.1016/j.cell.2020.08.023