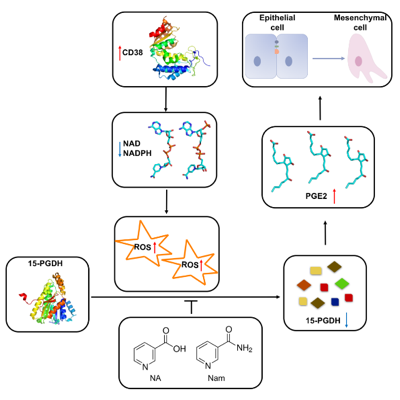
2018年1月4日,清华大学生命科学学院邓海腾研究组在《细胞化学生物学》期刊(Cell Chemical Biology)发表研究论文,题目为“ROS-mediated 15-Hydroxyprostaglandin Dehydrogenase Degradation via Cysteine Oxidation Promotes NAD+-Mediated Epithelial-Mesenchymal Transition”,揭示了烟酰胺腺嘌呤二核苷酸(NAD+)的降低通过活性氧分子介导的抑癌因子15-羟基前列腺素脱氢酶(15-PGDH)的降解驱动细胞发生上皮-间充质转化(EMT),提示补充NAD前体如维生素B3可以抑制肿瘤的发生和发展。
NAD是最重要的生物分子之一,在几乎所有的生理过程中都发挥着重要的作用。大量的研究证明在衰老过程中,哺乳动物的NAD水平由于CD38表达量的上升而降低,并伴随活性氧分子(ROS)水平的增加,而补充NAD前体可以延缓衰老并预防衰老相关疾病的发生。肿瘤的发生和发展也与衰老有着密切的关系。在本课题中,邓海腾研究组在非小细胞肺癌以及结肠癌细胞中构建了CD38过表达的稳转细胞系,发现CD38过表达或FK866(NAD合成限速酶NAMPT的抑制剂)处理会引起细胞内NAD水平的下降和ROS水平的增加,而NAD水平的下降直接驱动细胞发生EMT过程。EMT在肿瘤的发生、发展以及转移过程中都发挥着重要的作用。
进一步的分析发现NAD的下降导致15-PGDH蛋白的降解。15-PGDH是前列腺素E2(PGE2)合成酶COX-2的拮抗剂,是结肠癌、胃癌、肺癌等肿瘤中重要的抑癌基因。邓海腾研究组证实ROS引起15-PGDH的降解并导致PGE2的大量增加,而过表达15-PGDH可以抑制EMT过程。分析还发现蛋白酶体和自噬体都参与了15-PGDH的降解过程,并且其降解不是通过经典的泛素化-蛋白酶体通路,而是通过15-PGDH的第44位半胱氨酸残基的氧化磺酸化。Cys44的突变可以抑制或加强15-PGDH的降解。更重要的是,补充NAD前体可以抑制15-PGDH的降解和EMT过程。这项研究揭示了衰老过程中NAD下降和肿瘤发生与发展之间的关系,并提示NAD前体可以预防肿瘤的发生和发展。
清华大学生命科学学院PTN项目博士生王玮璇为本文的第一作者,邓海腾为通讯作者。该研究获得了国家自然科学基金委和科技部的资助。
论文链接:
http://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(17)30435-X