2018年6月20日,清华大学生命科学学院陈国强课题组在《先进材料》(Advanced Materials)杂志在线发表题为《细胞的诺亚方舟:聚羟基脂肪酸酯开放式多孔微球作为一种可用于组织修复的注射型支架》(A Micro‐Ark for Cells: Highly Open Porous Polyhydroxyalkanoate Microspheres as Injectable Scaffolds for Tissue Regeneration)的研究论文,该工作采用生物材料聚羟基脂肪酸酯(Polyhydroxyalkanoate, PHA)和气-水乳化技术(gas-in-oil-in-water double emulsion),设计出一种直径为300–360 μm的开放式多孔微球(Open porous microsphere, OPM),为再生医学、微创手术及干细胞治疗提供一种新的可注射型细胞载体工具。
PHA-OPM具备了PHA良好的生物相容性、微球的可注射性和组织工程支架的开放式三维空间结构的三重优势,是一种特殊的球状的三维培养载体。其特殊的开放式多孔结构能在体外培养时促进细胞向内生长;在注射运输过程中起到支撑作用,保护微球内部的细胞免于挤压和摩擦;并能实现动物体内释放细胞和组织修复的目的。由于PHA-OPM的操作过程和作用与圣经中诺亚方舟(躲避灾害将生命运输到新大陆)的作用很相似,所以PHA-OPM也被形象地称为细胞的诺亚方舟(Micro-Noah's Ark for cells)。
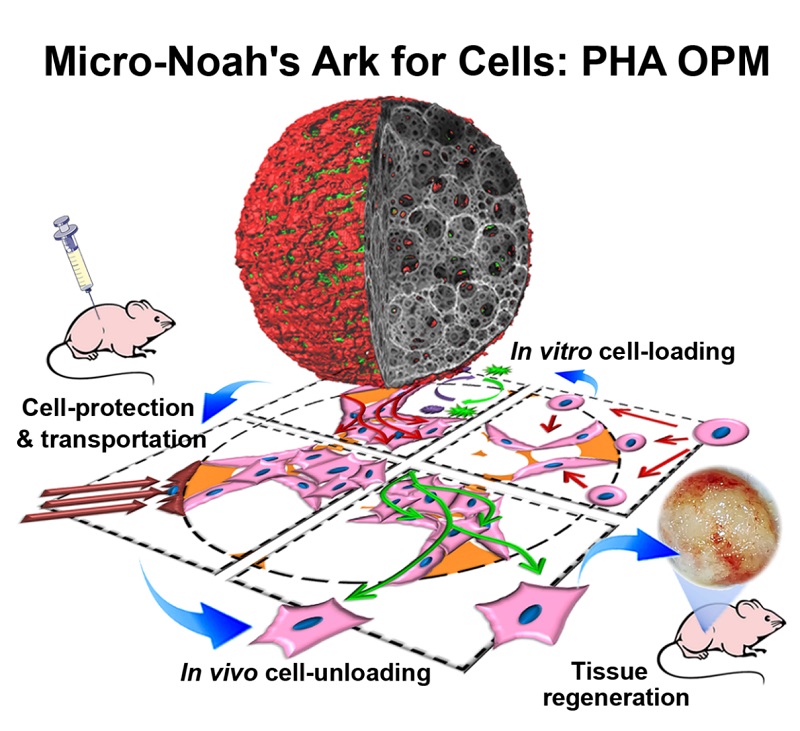
组织工程支架(Tissue engineering scaffolds)在组织医学和干细胞治疗中发挥着关键作用。采用传统手术进行的支架移植常伴随着大型开放式手术和术后感染等问题,直接影响患者生活。微创手术具有减少患者痛苦,操作方便,提高临床安全性等优势,近年来迅速发展。以聚合物水凝胶和微球为代表的可注射生物材料是目前最佳的微创手术使用的细胞载体,但也存在不足之处。
该工作通过接种人来源的骨髓间充质干细胞(hMSC),证实PHA-OPM 的细胞接种率远高于传统微球(PHA-HM),且能持续生长。通过该课题组自创的魏氏冷冻有序切割法(WEI Frozen Orderly Section)和三维重塑技术,可清晰地观察细胞从PHA-OPM表面向内部迁移的过程。该工作还进一步证实,PHA-OPM的开放多孔结构可显著保护大部分细胞免于注射时产生的压力和摩擦;也直接影响干细胞细胞定向分化和组织修复等结果。进行hMSC异体成骨修复测试,利用PHA-OPM为载体的实验组效果远优于其他对照组。
除了先进的开放式多孔结构,PHA-OPM还具有材料的优势。陈国强课题组一直从事PHA的微生物合成及应用研究,其研究成果已代谢工程、生物塑料、再生医学与组织工程、药物化学等领域发表多项成果。大量研究表明,PHA的生物相容性优于PLA为代表的其他聚酯材料。主要原因在于,PLA的主要降解产物乳酸为酸性的小分子物质,大量释放将影响细胞的生长,而PHA的主要降解产物3-羟基丁酸(3-hydroxybutyrate,3HB)的酸性远小于乳酸,具有更小的细胞刺激性,且一定浓度的3HB对细胞活性存在促进作用。因此,受乳酸快速释放的影响,采用PLA制备的开放式多孔微球(PLA-OPM),不论是细胞增殖、体外定向分化还是组织修复都不如PHA-OPM的效果显著。
清华大学生命学院陈国强教授为本工作的通讯作者。清华大学CLS博士生魏岱旭和生命学院博士生刀金威为本文共同第一作者。本课题得到了国家自然科学基金、清华-北大生命科学联合中心、合成与系统生物学中心等资助,并得到清华大学生物医学测试中心、清华大学实验动物中心和清华大学蛋白质设施实验技术中心的大力支持。
论文链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.201802273