2018年6月5日,清华大学生命学院杨雪瑞研究组在《癌症研究》(Cancer Research)发表长文《NEAT1在前列腺癌细胞中通过CDC5L-AGRN转录调控通路的促癌作用》(Oncogenic properties of NEAT1 in prostate cancer cells depend on the CDC5L-AGRN transcriptional regulation circuit)。文章中鉴定了长非编码RNA(lncRNA)NEAT1在前列腺癌细胞中的促癌作用,首次提出NEAT1协助转录因子CDC5L调控靶基因AGRN,从而促进肿瘤细胞增殖与肿瘤生长的新机制。
NEAT1是一种长约3.2kb的非编码RNA,它主要富集于细胞核中,是形成与维持细胞核亚结构paraspeckle的关键非编码RNA。在前列腺癌中,NEAT1被发现有促癌作用,但其分子机制并不清楚。杨雪瑞研究组的主要研究方向之一是lncRNA在癌症中的生理功能与分子机制。鉴于lncRNA种类复杂、功能多样、已知信息缺乏的现状,他们首先采用多组学大数据挖掘的手段,设计一系列数据整合分析算法,通过对细胞内转录调控关系的定量分析,鉴定影响重要转录调控通路的lncRNA分子。在本研究中,他们使用癌症大规模组学数据库TCGA(The Cancer Genome Atlas)的资源,基于约500例前列腺癌组织的多组学数据,系统分析了该类肿瘤环境中lncRNA对转录调控网络的影响。分析结果显示NEAT1可能调控多个转录因子的功能活性,其中转录因子CDC5L与NEAT1有直接的互作结合。在此基础上,他们设计了一系列分子生物学与癌症生物学实验,不仅验证了数据分析所作预测,而且详细阐明了NEAT1在前列腺癌中促癌作用的分子机制。
他们的研究发现,NEAT1招募并富集CDC5L蛋白至细胞核中的paraspeckle,促进CDC5L对靶基因AGRN的转录激活作用,而在前列腺癌细胞中,AGRN起到了促进DNA损伤修复的作用。对NEAT1表达水平的敲低抑制了CDC5L-AGRN转录调控通路的活性,导致前列腺癌细胞DNA损伤的累积,从而影响了细胞周期与增殖。事实上,许多肿瘤中有p53等DNA损伤修复机制的缺失,因此,在肿瘤细胞中诱导大规模DNA损伤有抑制肿瘤发展的功能。杨雪瑞研究组首次发现非编码RNA NEAT1在控制DNA损伤,维持肿瘤细胞增殖与细胞周期中的关键作用。基于此机制,NEAT1表现出作为前列腺癌治疗靶点的潜力。
总之,此研究体现了围绕重要生物学问题,合理高效的大数据分析策略在发现生物学线索、预测功能与机制、提出可验证假说等方面的独特优势。特别是针对缺乏研究积累及研究线索的lncRNA功能研究,深度的数据挖掘与预测可以有效指导后续的机理研究。杨雪瑞研究组将继续采用该“干、湿实验”结合的策略,系统研究lncRNA以及其它调控因子在肿瘤发生发展中的作用机制。
清华大学生命学院博士生李新为本文的第一作者,杨雪瑞研究员为本文的通讯作者。本研究由国家重点研发计划“精准医学研究”重点专项、国家自然科学基金委、清华-北大生命科学联合中心、清华大学自主科研项目提供经费支持。清华大学蛋白质研究技术中心基因测序平台、生物计算平台、shRNA文库、细胞功能与影像平台及实验动物中心对本课题的研究提供了有力的支持。
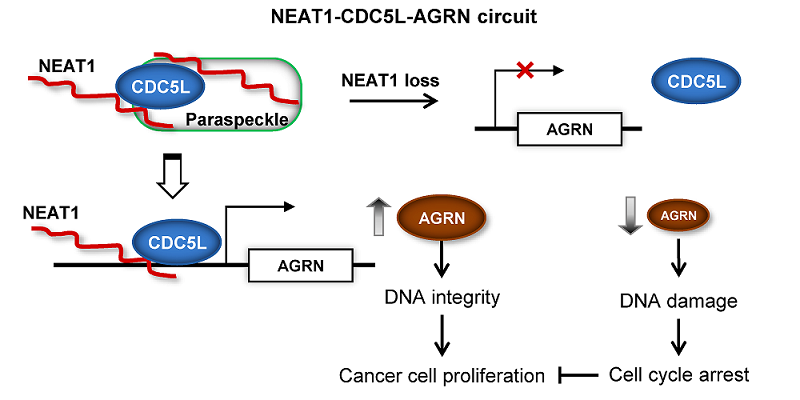
图示: 长非编码RNA NEAT1通过CDC5L-AGRN转录调控通路影响前列腺癌细胞周期与增殖的作用机制。
链接如下:http://cancerres.aacrjournals.org/content/early/2018/06/05/0008-5472.CAN-18-0688