8月13日,清华大学医学院向烨副教授、生命科学学院王新泉教授在《公共科学图书馆·病原体》(Plos Pathogens)期刊在线发表题为《SARS冠状病毒刺突糖蛋白与其受体ACE2复合物的冷冻电镜结构》(Cryo-EM structure of the SARS coronavirus spike glycoprotein in complex with its host cell receptor ACE2)的研究论文。该两个研究组曾于2017年在《细胞研究》(Cell Research)杂志上报道SARS冠状病毒刺突糖蛋白的冷冻电镜结构,并提出了其结合受体所必需的构象状态。本论文在前论文的基础上深入研究,首次解析了高致病冠状病毒SARS-CoV 表面刺突糖蛋白(S)与其受体ACE2复合物的近原子分辨率结构,并捕捉到S蛋白在结合受体后发生的多种构象变化,揭示了SARS-CoV冠状病毒S蛋白识别受体,介导病毒-宿主细胞膜融合过程中的必需的动态结构变化。
2002年爆发的SARS,感染范围广泛,波及全球,感染人数高达8273人,共引起775人死亡,其致死率高达10%。今年二月份,世界卫生组织列出了可能对世界公共卫生产生巨大威胁的10种病毒, SARS-CoV位列其中。迄今为止,还没有研发出针对SARS-CoV的特异性药物,以及针对冠状病毒的广谱特效药物,其仍具有对人类健康造成巨大威胁的潜在隐患。SARS-CoV的S蛋白介导冠状病毒与受体的结合以及膜融合,是病毒颗粒侵入宿主细胞过程中关键蛋白,同时也是宿主中和抗体免疫应答的主要作用位点。在病毒表面,S蛋白以同源三聚体形式存在,其单体可被蛋白酶识别,切割分为S1和S2两个亚基。其中S1上存在受体结合结构域,主要负责受体识别;S2含有第二个酶切位点、膜融合肽以及两个heptad repeat结构域,其主要功能是介导膜融合。冠状病毒表面的S蛋白对决定病毒的宿主范围和组织嗜性起关键性作用,对病毒囊膜与宿主细胞膜的融合起决定性作用。
高致病性冠状病毒SARS-CoV入侵宿主细胞通过两种可能途径,一种是受体介导的内吞途径,另一种是直接膜融合途径,即病毒包膜直接与细胞膜融合,将病毒基因组注入到细胞质内。综合SARS-CoV 入侵宿主细胞的途径,受体、低pH环境以及蛋白酶可能诱导S发生构象变化,从而促进了膜融合过程的发生。向烨研究组和王新泉研究组通过模拟SARS-CoV 入侵宿主细胞的内环境,结合冷冻电镜单颗粒技术与生化手段,解析了蛋白酶切割后处于中性和酸性环境中的S蛋白的构象,以及蛋白酶切割后中性和酸性环中S蛋白与受体结合的多种不同构象,并捕捉到S蛋白结合受体后发生的构象变化以及融合后的构象,最高分辨率达3.6?。通过对不同结构的分析与比较,研究者首先证实了前期提出的S蛋白受体结合所必需的构象状态,并且发现受体ACE2的结合使得S蛋白的C端结构域(CTD1,即受体结合结构域)继续向外偏转,诱导S1-ACE2脱落及S2亚基结构变化并暴露融合肽。该研究结果承接前面的研究进展,并填补了冠状病毒糖蛋白介导膜融合研究领域的空白。
清华大学生命科学学院2014级博士生宋文飞和医学院博士后、结构生物学高精尖创新中心卓越学者桂淼为本论文的共同第一作者,向烨副教授和王新泉教授为本论文的共同通讯作者。
该工作的冷冻电镜数据采集在国家蛋白质科学设施(北京)的清华大学冷冻电镜平台完成,数据处理在国家蛋白质科学设施(北京)清华大学高性能计算平台完成。本工作获得国家自然科学基金委、科技部重点研发计划和北京市结构生物学高精尖创新中心等的经费支持。
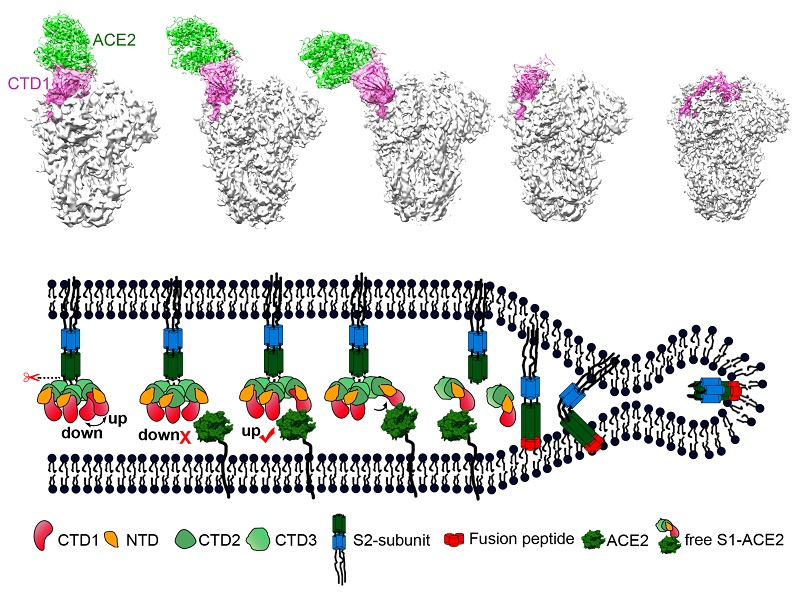
SARS-CoV刺突糖蛋白与受体的复合物结构及刺突糖蛋白的相应构象变化