肾脏是人体重要的生命器官,具有排出体内代谢产物,调节水、电解质平衡和调节内分泌系统等诸多生理功能。在多种病理条件下,肾脏需将脏器内的血液排出并供给心脏和大脑这些更重要的器官,因此肾脏是最容易受到损伤的器官之一。遗传因素、高血糖和高血脂等均是慢性肾脏病的重要诱因。据美国国立卫生研究院统计,美国成人(总数约2亿)慢性肾脏病的患病率已高达11.3%。
常染色体显性遗传多囊肾病(ADPKD)是慢性肾脏病的重要诱因之一,发病率为1/400-1/1000,全球约1200万患者深受这一疾病的影响。患者双侧肾脏会随着年龄的增长逐渐产生液体充斥的囊泡,挤压并影响周围正常组织。约50%患者会发展到终末期肾功能衰竭,需要进行异源肾脏移植或者终身血液透析治疗。我国约有150万此疾病患者,每年都有数以万计的患者苦苦等待无偿捐献的肾源或者通过无休止的透析维持生命。ADPKD不仅给患者造成严重的身体和精神上的折磨,同时给患者家庭带来沉重的经济负担。
与ADPKD致病相关的基因为pkd1和pkd2,其基因产物分别为膜蛋白PKD1和PKD2。二者的突变在所有病人中分别占到大约85%和10%的比例。人源pkd1基因定位于16号染色体,编码了长度为4302个氨基酸包含11次跨膜螺旋的蛋白PKD1。由于PKD1分子量十分巨大,研究人员对其研究一直面临着极大的技术难度。自1993年对pkd1基因测序成功,20多年来众多科学工作者对该蛋白进行了坚持不懈地研究。尽管这些研究拓宽了人们对ADPKD的认知,但由于缺乏足够信息,PKD1蛋白的功能以及多囊肾病的发病机理,尚存争议。另外一个致病蛋白PKD2,是PKD1的伴侣分子,对PKD1的折叠、在细胞器间的转运、和蛋白成熟具有极其重要的作用。PKD1和PKD2蛋白可以相互作用,形成异源四聚体复合物,并可能在初级纤毛 (primary cilia) 上行使重要生理学功能。
北京时间2018年8月10日,施一公研究组在《科学》(Science)期刊在线发表了题为《人源PKD1和PKD2复合物的结构》(Structure of the human PKD1/PKD2 complex)的研究长文,首次报道了多囊肾病相关蛋白PKD1和PKD2复合物整体近原子分辨率(3.6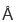 )的冷冻电镜结构。
)的冷冻电镜结构。
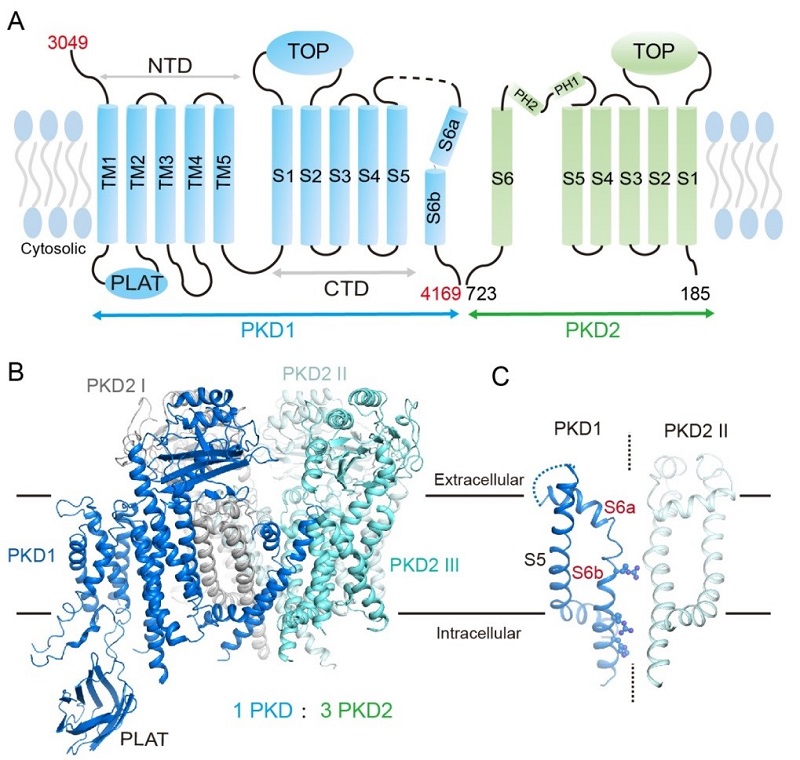
图1:A.人源PKD1和PKD2蛋白的拓扑结构示意图。B.人源PKD1和PKD2蛋白复合物结构;C.人源PKD1独特的通道结构域。
施一公课题组首次解析了人源PKD1和PKD2复合物的近原子分辨率结构。该结构揭示:PKD1和PKD2蛋白形成了独特的一比三的复合物 ( 1 PKD1: 3 PKD2 )。根据该结构和生化数据,研究组发现PKD1和PKD2在没有蛋白C端卷曲螺旋结构域的情况下仍能形复合物。这与之前认为“没有卷曲螺旋结构域时二者不能形成蛋白复合物”的主流学说并不一致,使得众多基于此结论的研究需要重新斟酌。除此之外,研究人员还发现PKD1的通道结构域与目前所有已知的电压门控离子通道类似折叠蛋白均不同。PKD1的S6穿膜螺旋上有许多带正电的氨基酸指向通道中心空腔,堵住了类似钙离子通道的中心孔道路径。之前领域内针对PKD1和PKD2是否形成钙离子通道有诸多争论,此结构目前的构象不支持通道假说,给多囊肾病的机制研究带来全新的思考。
施一公课题组与上海长征医院梅长林教授、郁胜强教授合作,从2013年开始攻坚人源PKD1和PKD2这两个蛋白的结构,经过5年的不懈努力,尝试和筛选了大量的去垢剂、蛋白边界和冷冻制样条件,终于解析了整体分辨率为3.6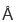 的PKD1和PKD2蛋白复合物的结构,其核心区域分辨率可以达到3.2
的PKD1和PKD2蛋白复合物的结构,其核心区域分辨率可以达到3.2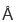 ,为多囊肾病的致病机理研究迈出了极为艰难的一步,这也是首次获得TRP通道家族异源复合物的结构。清华大学生命学院、结构生物学高精尖创新中心施一公教授为本文的通讯作者;清华大学生命学院三年级博士研究生宿强和医学院胡斐卓博士为该文的共同第一作者;清华大学生命学院六字班本科生葛霄飞帮助完成部分实验。清华大学冷冻电镜平台的雷建林博士为冷冻电镜数据收集提供了帮助。清华大学医学院副研究员周强对冷冻电镜数据处理进行了指导。清华大学医学院副研究员王廷亮参与了课题的早期操作。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本工作获得了北京结构生物学高精尖创新中心及国家自然科学基金委的经费支持。
,为多囊肾病的致病机理研究迈出了极为艰难的一步,这也是首次获得TRP通道家族异源复合物的结构。清华大学生命学院、结构生物学高精尖创新中心施一公教授为本文的通讯作者;清华大学生命学院三年级博士研究生宿强和医学院胡斐卓博士为该文的共同第一作者;清华大学生命学院六字班本科生葛霄飞帮助完成部分实验。清华大学冷冻电镜平台的雷建林博士为冷冻电镜数据收集提供了帮助。清华大学医学院副研究员周强对冷冻电镜数据处理进行了指导。清华大学医学院副研究员王廷亮参与了课题的早期操作。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本工作获得了北京结构生物学高精尖创新中心及国家自然科学基金委的经费支持。
原文链接:http://science.sciencemag.org/content/early/2018/08/08/science.aat9819