2018年7月20日,清华大学生命科学学院杨茂君教授研究组在《细胞研究》(Cell Research)在线发表题为《14个亚基组成的人源细胞色素c氧化酶的完整结构》(Structure of the intact 14-subunit human cytochrome c oxidase)的研究论文,首次报导了人源细胞色素c氧化酶(呼吸链复合物IV)的完整结构,分辨率达到3.3 。完整的人源细胞色素c氧化酶由14个亚基组成一个单体,而不是教科书中所认为的两个13个亚基组成的二聚体,这项工作纠正了二十多年来在细胞色素c氧化酶的结构生物学研究中的错误,拓展了对细胞色素c氧化酶的认识与理解。
。完整的人源细胞色素c氧化酶由14个亚基组成一个单体,而不是教科书中所认为的两个13个亚基组成的二聚体,这项工作纠正了二十多年来在细胞色素c氧化酶的结构生物学研究中的错误,拓展了对细胞色素c氧化酶的认识与理解。
呼吸作用是细胞内最基本的能量代谢活动之一,生物体摄入的有机物在细胞内通过一系列生化反应后生成水、二氧化碳和其他产物,并释放出能量。线粒体呼吸链位于线粒体的内膜上,包含四个膜蛋白复合物以及电子传递配体辅酶Q和细胞色素c等。这四个蛋白质复合物分别是复合I(NADH脱氢酶),复合物II(琥珀酸脱氢酶),复合物III(细胞色素c还原酶)和复合物IV(细胞色素c氧化酶)。线粒体呼吸链将电子转移到氧的同时,把质子泵到线粒体膜间隙内产生质子梯度并驱使ATP合成酶(复合物V)合成能量分子ATP。
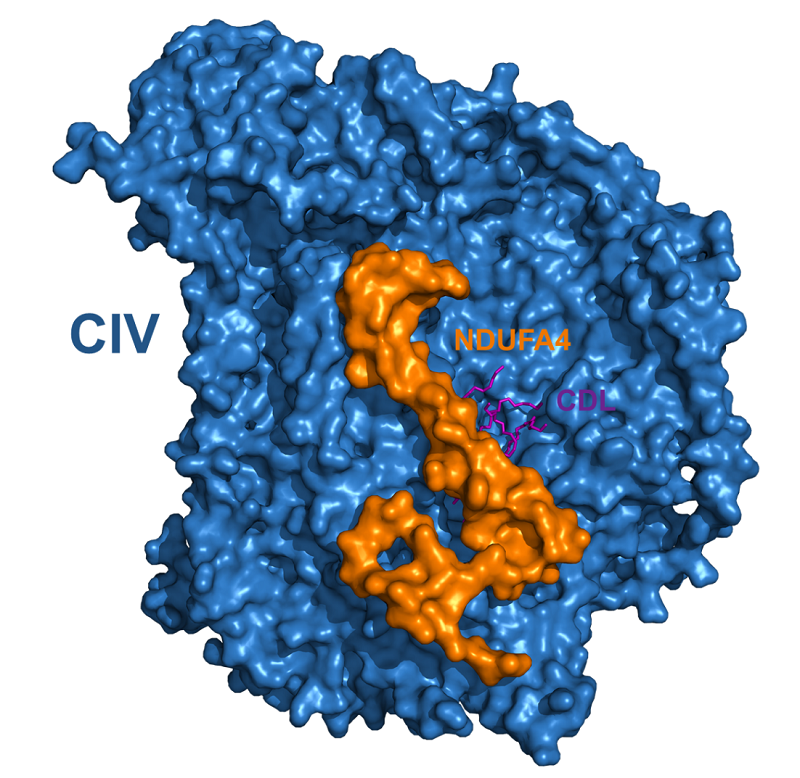
图1. 完整的人源细胞色素c氧化酶示意图。CIV,细胞色素c氧化酶;NDUFA4,细胞色素c氧化酶的第十四个亚基;CDL,心磷脂。
自1995年原核细胞色素c氧化酶的结构被解析以来,从原核至真核,从简单到复杂,复合物IV的结构不停涌现。与此同时,科学界一直认为细胞色素c氧化酶是一个同源二聚体,由两个各包含13个亚基的单体组成。但是在本工作中,通过使用冷冻电镜收集数据并处理后,杨茂君教授解析了人源细胞色素c氧化酶迄今为止分辨率最高的结构。通过对过往实验结果的归纳总结和对新获取的数据进行分析,杨茂君教授在3.3 的电子密度中搭建出了细胞色素c氧化酶的第14个亚基NDUFA4以及与它相互作用的心磷脂,首次确定了完整的细胞色素c氧化酶的各个亚基的位置,并提出了完整的细胞色素c氧化酶是由14个亚基组成的并以单体形式存在。
的电子密度中搭建出了细胞色素c氧化酶的第14个亚基NDUFA4以及与它相互作用的心磷脂,首次确定了完整的细胞色素c氧化酶的各个亚基的位置,并提出了完整的细胞色素c氧化酶是由14个亚基组成的并以单体形式存在。
在杨茂君教授解析的呼吸链超级复合物结构中,细胞色素c氧化酶的组成状态均为单体,生化实验中抽提纯化出的细胞色素c氧化酶也均为单体,但是过往的晶体结构中细胞色素c氧化酶都是同源二聚体。在本工作中,杨茂君教授发现了第14个亚基NDUFA4,它处于二聚的晶体结构中的二聚结合界面上,并有一个心磷脂分子与它相互作用。在过往的晶体结构研究中,纯化的步骤使用了性质较强的去垢剂,导致稳定结合在细胞色素c氧化酶中的心磷脂分子被替换掉,而NDUFA4也从细胞色素c氧化酶解离出来。这样形成的二聚的细胞色素c氧化酶与体内的状况不一致,也导致学术界一直认为细胞色素c氧化酶是一个同源二聚体。NDUFA4结构的解析解决了这个矛盾,并解释了晶体结构中细胞色素c氧化酶二聚的原因。在本工作中杨茂君教授还发现,与之前牛源细胞色素c氧化酶不同,Cox7A2、Cox6A1和Cox8A分别替代了亚基Cox7A1、Cox6A2和Cox8B,这三个亚基的结构首次被解析。
清华大学生命科学学院的博士后宗帅、博士生吴萌、结构生物学高精尖创新中心卓越学者谷金科和博士生刘天涯为本文共同第一作者,清华大学杨茂君教授为本文通讯作者。电镜数据采集于清华大学冷冻电镜平台。本工作获得清华大学结构生物学高精尖中心、国家蛋白质科学研究(北京)设施清华基地、清华-北大生命联合中心、清华大学自主科研基金、清华大学蛋白质科学教育部重点实验室、科技部重大科学研究计划专项、国家杰出青年基金和国家自然科学基金的大力支持。