2018年7月9日,清华大学生命学院李蓬课题组在Diabetes在线发表题为《脂滴、过氧化物酶体和线粒体通过CIDE-ATGL-PPARα通路协同作用调控脂肪细胞能量代谢》(Coordination Among Lipid Droplets, Peroxisomes and Mitochondria Regulates Energy Expenditure Through the CIDE-ATGL-PPARα Pathway in Adipocytes)的研究论文。该工作利用小鼠模型、细胞和分子生物学手段阐述了脂滴-线粒体-过氧化物酶体协同作用调控脂肪细胞能量代谢的机制。
脂肪细胞的脂代谢在维持全身的脂稳态中起到重要作用。脂肪细胞中脂肪的过多积累会导致肥胖(obesity),而脂肪细胞脂肪积累的缺陷则导致脂肪的异位储存于其它脏器,如肝脏和心脏等(lipodystrophy),二者均导致机体脂代谢紊乱而引起一系列代谢性疾病,如胰岛素抵抗、脂肪肝和炎症反应等。脂滴是细胞内储存脂类的重要细胞器。脂滴的动态变化(生成、融合、长大、降解)和脂代谢疾病的发生密切相关,而脂滴的动态变化和其他细胞器如线粒体、内质网、自噬体的关系也不清楚。尽管脂滴是一种在不同物种和不同细胞类型中都存在的细胞器,它更为丰富地分布在脂肪细胞中,因此脂肪细胞是研究脂滴与其它细胞器互作的重要细胞类型。
Cidea和Cidec蛋白在脂肪细胞中高丰度表达,并且都能够定位于脂滴表面,参与脂肪细胞的能量代谢。在该研究中,以Cidea/Cidec蛋白为研究对象,作者阐述了脂滴和其他细胞器的协同作用模式,以及该协同作用对脂肪细胞和机体全身代谢的影响。首先,研究者构建了多种动物模型,发现Cidea和Cidec双敲除小鼠代谢率明显增加,其白色脂肪组织和褐色脂肪组织脂积累明显下降,脂肪组织中脂滴明显变小,双敲除小鼠的胰岛素敏感性显著提高。对其肪组织进行基因表达谱分析,发现缺失Cidea/Cidec后脂肪组织基因表达谱发生明显改变,其中脂肪酸氧化磷酸化相关的通路明显增加;进一步的细胞生物学的检测发现,Cidea和Cidec双敲除脂肪细胞中线粒体和过氧化物酶体的数目明显增多,脂肪酸的氧化代谢明显增加。该研究显示脂滴作为细胞内的重要细胞器,其代谢的变化可以在基因水平上改变细胞的代谢状态,并通过增加线粒体和过氧化物酶体的功能来实现脂肪酸的水解-释放-氧化过程。该研究阐述了脂滴-线粒体-过氧化物酶体的协同作用在脂解-脂肪酸氧化中的重要作用。
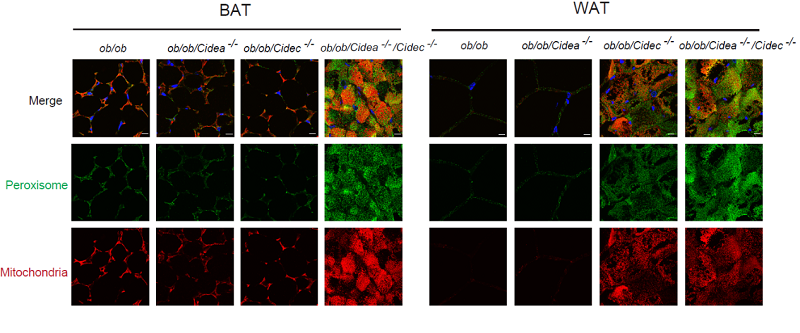
图1:Cidea和Cidec的缺失导致线粒体和过氧化物酶体增加。
进一步分子机制分析,Cidea和Cidec的缺失导致脂肪降解酶ATGL活性上升、游离脂肪酸增多,游离脂肪酸作为配体激活PPARα及其下游的过氧化物酶体和线粒体通路,导致脂肪消耗增加。
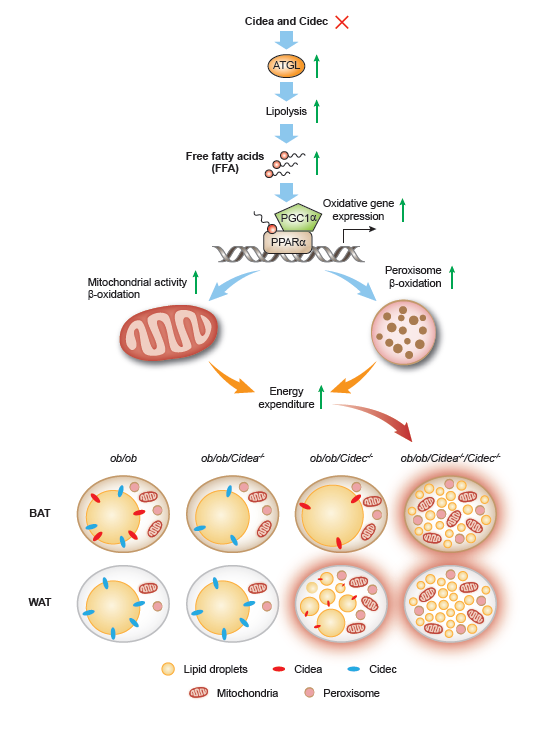
图2:CIDE-ATGL-PPARα调控脂肪细胞代谢示意图
由于脂肪细胞脂滴丰富,尤其白色脂肪细胞中的单室大脂滴占据了细胞的90%的比例,其它细胞器丰度低,使得在脂肪细胞中研究脂滴与其它细胞器的互作有一定难度。本研究巧妙地借助肥胖背景下的Cidea和Cidec均缺失的小鼠(ob/ob/Cidea-/- /Cidec-/- )及其脂肪细胞为研究模型,呈现了能量代谢非常旺盛的模式下,白色脂肪细胞和褐色脂肪细胞能量代谢的同时启动,同时这些细胞内脂滴-过氧化物酶体-线粒体三者间的协同作用,极大地提高了脂解、脂肪酸氧化及氧化磷酸化过程,从而调控了机体全身代谢的影响,为代谢性疾病的防治提供新的思路。
清华大学生命学院博士后周林康和博士生郁苗为本文共同第一作者,李蓬院士和徐俐博士为共同通讯作者。本研究得到了国家自然科学基金、科技部重点研发计划、膜生物学国家重点实验室以及清华-北大生命科学联合中心的资助,并得到清华大学生物医学测试中心的大力支持。
论文链接:
http://diabetes.diabetesjournals.org/content/early/2018/07/03/db17-1452