2019年6月14日,清华大学生命科学学院杨茂君教授及其研究团队,在国际顶级期刊《科学》(Science)杂志发表了题为《结合IF1抑制蛋白的哺乳动物ATP合酶四聚体冷冻电镜结构》(Cryo-EM structure of the mammalian ATP synthase tetramer bound with inhibitory protein IF1)的研究长文,通过高性能冷冻电镜技术,解析了分子量高达280万道尔顿的哺乳动物ATP合酶四聚体6.2埃的结构,以及完整的(19种亚基)、两种状态的ATP合酶单体3.34埃和3.45埃结构(图1)。通过对结构的分析,阐释了高等哺乳动物ATP合酶的结构组成样式、发挥功能的分子机理、复合物之间协同关系以及对线粒体嵴的形态的影响,为治疗能量代谢疾病、神经退行疾病等,提供了重要的实验依据及结构基础。
杨茂君教授研究团队长期致力于线粒体呼吸链蛋白的结构与功能研究,此前曾于2012年在《自然》(Nature)杂志报道了II-型线粒体呼吸链复合物I(NDH2)的结构,揭示了其调控及电子传递机制;2017年杨教授研究团队又分别在《PCCP》、《JMC》等杂志连续报道了NDH2的详细电子传递机制,为开发新的抗疟药物打下了良好的基础。
经过多年的努力,杨茂君教授研究团队于2016年终于攻克了哺乳动物线粒体呼吸链超级复合物的原子分辨率结构这一难题。2017年,杨茂君教授研究团队经过大量探索,首次从体外培养的人源细胞中分离、纯化出高纯度的呼吸链蛋白复合物,并且首次发现并解析了人源超超级复合物I2III2IV2中高分辨率三维结构。人源线粒体呼吸链复合物纯化方法的建立及其结构的解析,为今后的药物研发打下了良好的基础。此外,杨教授研究团队还在高等动物呼吸链复合物III非对称结构、人源呼吸链复合物IV 14亚基完整结构等方面取得重要的进展。
在此次发表的论文中,杨茂君教授研究团队首次分离、纯化出哺乳动物ATP合酶四聚体蛋白。由于该四聚体蛋白由多达120个亚基组成,各个亚基排布松散,非常不稳定,如果增加纯化步骤提高纯度会一定程度破坏其完整性;相反,粗提取的蛋白不能满足冷冻电镜样品的要求,目的颗粒所占比例过低,无法收集到足够多的蛋白颗粒用于计算。面对这样的难题,杨茂君教授研究团队通过反复实践,优化实验条件,在两者之间选取了很好的平衡点,既保证了该超大复合物蛋白的完整性,同时又满足了冷冻电镜数据收集的要求。
然而,由于该结构过于巨大,且存在多种构象,在尝试了几乎所有能够利用的计算程序和方法之后,依然无法得到该超大蛋白质机器的高分辨率结构。在对初步计算结果深度分析之后,杨教授敏锐的发现,在该H型的ATP合酶四聚体蛋白中,对角的两个ATP合酶复合物单体具有相似的构象。进而杨教授采用了一种新的计算方法,将四聚体中四个ATP合酶拆分后重新居中,然后单独挖出颗粒,进而将对角构象相似的颗粒合并。这样做不仅极大的缩小了计算中的分子尺度,而且还能提高颗粒数量。在后续的计算中逐步将这两类不同构象的ATP合酶复合物单体的分辨率提高到了原子分辨率水平。
对于这种新颖的纯化及计算方法,审稿专家给予了高度的评价:“Their approach of mild, partial purification combined with the collection of a large image data set will open new avenues in the structural biology of highly fragile complexes that are not amenable to standard purification procedures”(他们将温和、部分提取纯化的方法与大数据收集相结合,该方法将为不能采用常规纯化手段获得的、高度脆弱的蛋白复合物的结构生物学研究开辟新的途径)。
文章重点报道了目前发现的最完整的哺乳动物ATP合酶单体结构,以及各个亚基在复合物中的位置和功能。ATP合酶单体是由19种不同的亚基,共有30个蛋白来构成的超大复合物。新鉴定的亚基多包裹于ATP合酶四聚体中间区域,意味着只有在四聚体蛋白中才能包含全部亚基。两种不同构象的ATP合酶单体结构完美的解释和验证了哺乳动物ATP合酶合成ATP的分子机制。
ATP合酶四聚体由120个蛋白亚基构成,是由两个相似的构象的ATP合酶二聚体通过反向平行组合在一起形成一个四聚体,四聚体在跨膜区形成一个高曲率的曲面,可以很好的解释它们在线粒体嵴上的排布方式。本次解析的ATP合酶四聚体处于活性抑制状态。线粒体内膜上存在大量的蛋白质,其中蛋白与磷脂的比例大约是7:3,ATP合酶分子大约占到所有蛋白的20%左右。大多数ATP合酶平常都会处于抑制状态,只有在细胞需要大量能量的时候才会被激活合成ATP分子。
本次研究发现ATP合酶四聚体在多个位点上实行协同抑制-激活机制。当线粒体基质质子浓度升高,内膜两侧质子浓度差降低时,IF1蛋白亚基会通过其C端形成二聚体,其N端深深的插入到ATP合酶行使催化功能的F1部分,阻止ATP合酶催化亚基构象变化,使其不能合成ATP分子。二聚的IF1将ATP合酶四聚体中F1部分两两固定的在一起。当线粒体基质质子浓度降低时,质子浓度差升高时,IF1蛋白会形成四聚体,将其N端从ATP合酶的F1部分抽离出来,解除这种抑制。与此同时,质子浓度差降低时,在ATP合酶的膜间隙一侧,e亚基的C端会与位于c8-ring中间的6.8PL亚基的C端结合,进而抑制c8-ring的转动。反之,抑制解除。总而言之,ATP合酶可以感知线粒体内膜两侧质子梯度的变化,进而调整其活性。
在文章的审稿过程中,审稿人对于该研究给予了很高的评价“The IF1-inhibited tetramer structure is a “first” for any F-ATP synthase and also the first truly intact structure of a mammalian enzyme, a feat that has eluded structural biologists for decades despite intense efforts in many labs across the world.”(IF1抑制的四聚体结构是“第一个”F型ATP酶的四聚体结构,也是哺乳动物ATP合酶第一个真正意义上的完整结构,几十年来,世界范围内众多结构生物学家为之进行了大量的努力,都没能完成杨教授团队这样的壮举)。杨茂君教授研究团队将再接再厉对线粒体氧化磷酸化系统进行更加深入的研究,并将致力于研发治疗线粒体异常疾病的新型靶向药物。
清华大学生命科学学院谷金科(博士后)、张来幸(15级博士生)、宗帅(结构生物学高精尖创新中心卓越学者)、郭润域(结构生物学高精尖创新中心卓越学者、水木学者)是此篇论文的共同第一作者,杨茂君教授为本文的通讯作者。刘天涯(16级)、易静波(18级)、卓微(博士后)也参与了相关研究工作。此外特别感谢南方科技大学冷冻电镜中心主任王培毅教授,没有王教授在关键时刻给予的大力支持,就没有此工作的顺利开展和取得这一重大研究进展。本工作受到了科技部重点研发计划、国家自然科学基金委、清华大学结构生物学高精尖中心、清华-北大生命科学联合中心及清华大学自主科研计划的大力支持。
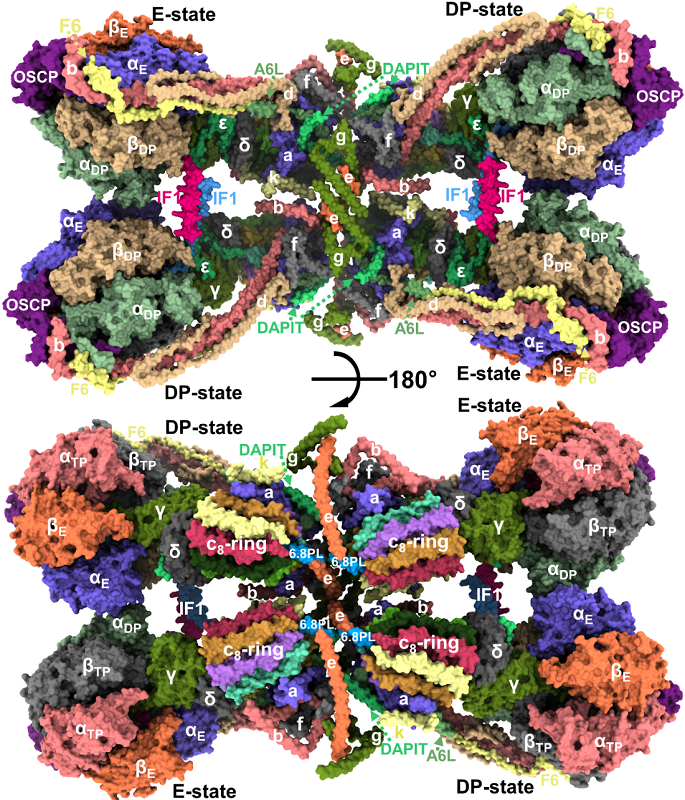
图1 哺乳动物ATP合酶四聚体整体结构
原文链接:https://science.sciencemag.org/content/364/6445/1068
相关论文链接:https://www.nature.com/articles/nature11541;
https://doi.org/10.1038/nature19359;
https://www.cell.com/cell/fulltext/S0092-8674(16)31533-1;
https://www.cell.com/cell/fulltext/S0092-8674(17)30887-5
https://link.springer.com/article/10.1007%2Fs13238-018-0515-x;
http://dx.doi.org/10.1038/s41422-018-0071-1。