长期对抗病原生物的过程中,植物进化出了复杂高效的两层免疫系统,用于识别各种病原微生物、激活防卫反应保护自己。处于两层免疫系统的核心是植物细胞内数目众多的抗病蛋白,它们既是监控病虫侵害的哨兵,也是植物动员高效防卫系统的指挥官。抗病蛋白被发现及在植物育种中大量应用已有二十多年,但人们对其发挥作用的分子机制仍不清楚。清华大学柴继杰团队、中国科学院遗传与发育生物学研究所周俭民团队、和清华大学王宏伟团队最近的联合研究,在植物免疫研究领域取得历史性的重大突破。合作团队发现由抗病蛋白组成的抗病小体并解析了其处于抑制状态、中间状态及五聚体活化状态的冷冻电镜结构,从而揭示了抗病蛋白管控和激活的核心分子机制。相关成果以两篇长文(Research Article)形式分别以“病原蛋白诱导的ADP解离启动植物抗病蛋白”(Ligand-triggered allosteric ADP release primes a plant NLR complex)和“植物抗病小体的重组和结构功能基础”(Reconstitution and structure of a plant NLR resistosome conferring immunity)为题目,于2019年4月5日发表在国际权威学术期刊Science《科学》。Science杂志同期发表了国际植物抗病研究权威科学家Jeffery Dangl和Jonathan Jones撰写的题为“耀眼的五星:植物抗病小体”(A pentangular plant inflammasome)的专文评述,高度评价这一重大突破性成果。
植物抗病蛋白表达在正常植物细胞内受到严格的调控,且其活化会导致感病局部细胞组织的超敏性死亡(HR),使得植物体内抗病蛋白介导的信号通路研究非常困难。植物抗病领域急切需要抗病蛋白的全长抑制及活化状态的结构来整合以往海量的遗传信息并指导植物抗病机制的深入研究。因此,抗病蛋白理论研究的一个巨大瓶颈在于缺乏蛋白质结构,这正是柴继杰团队2004年成立以来的主攻方向。
但植物抗病蛋白作为多结构域的蛋白经常具有分子量大及构像多变等特点,导致体外的纯化重组及结构研究非常困难。自从25年前国际上首次鉴定到抗病蛋白以来,多个国际顶尖实验室均未能纯化出可供结构分析的全长抗病蛋白质。柴继杰团队自2004年成立以来就开始在数量众多的植物抗病蛋白中进行理想研究对象的繁重筛选工作,在十几年里的研究经历中数十位博士研究生在植物抗病蛋白的大量表达、高质量纯化和体外重组等方面积累了大量的宝贵经验。2013年底,柴继杰团队成功筛选到用于结构生物学研究的理想候选ZAR1,但病原菌蛋白HopZ1a未能成功激活ZAR1抗病蛋白。周俭民团队在2015年发现了病原细菌和植物之间令人惊叹的攻防策略:病原细菌的一个致病蛋白AvrAC精准破坏植物免疫系统中的关键组分,帮助细菌侵染植物寄主;而植物则利用特殊的“诱饵”PBL2和RKS1蛋白,感知AvrAC的活动并将信息传递给植物抗病蛋白ZAR1,迅速激活免疫反应,清除细菌。之后两个团队就ZAR1抗病蛋白的结构生物学研究展开紧密合作,以前在长期合作中形成的理论和实验体系,也为这一课题的顺利合作奠定了基础。同时王宏伟团队长期致力于冷冻电镜方法学的研究和改善,尤其在使用相位板技术解析小分子量蛋白质的结构方面经验丰富,因此在较短时间内解析具有小分子量抗病蛋白非激活状态的高分辨率结构具有很大可能性。同时,柴继杰团队近年在动物炎症小体结构研究中取得了突破,由于组成炎症小体的蛋白与植物抗病蛋白具有诸多相似性,这些研究为解析植物抗病蛋白结构积累了宝贵经验。
在上述研究的基础上,三个团队进一步合作,以AvrAC与ZAR1为体系研究植物抗病蛋白结构。经过多年协作攻关,成功地解析了植物抗病蛋白抑制状态复合物RKS1-ZAR1、识别-启动状态复合物PBL2UMP-RKS1-ZAR1、和激活复合物 (抗病小体,resistosome)的结构,详细阐述植物抗病蛋白的工作机理。在第一篇文章中,ZAR1通过自身多结构域组成的分子内互作和ADP分子介导的自我抑制机制被具体揭示(图1A);植物抗病蛋白通过识别病原菌蛋白AvrAC导致其核酸结合结构域(NBD)的构象变化和释放ADP分子,从而解除ZAR自抑制进入启动状态(图1B和1C)。
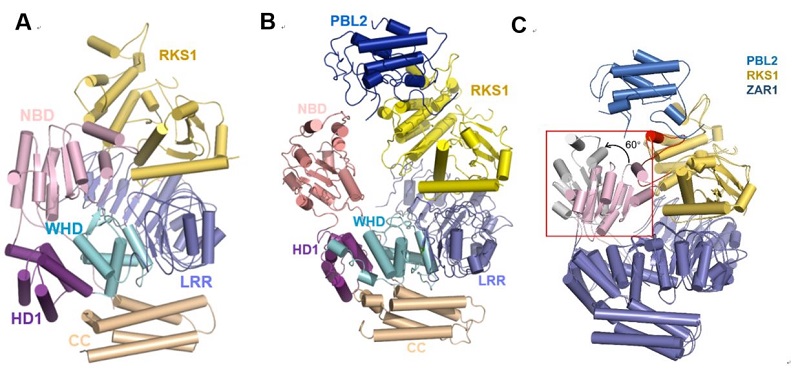
图1 植物抗病蛋白的抑制状态结构(A)、识别-启动状态结构(B)和启动机理(C)示意图
在第二篇文章中,ZAR1被AvrAC激活后,组装成含三个亚基共15个蛋白的环状五聚体蛋白机器,植物抗病蛋白的第一个激活复合物被成功捕捉并被正式命名为“抗病小体”(resistosome) (图2)。更为重要的是,抗病小体结构的解析为理解其生化功能提供了线索,奠定植物控制细胞死亡和免疫新模型的建立。
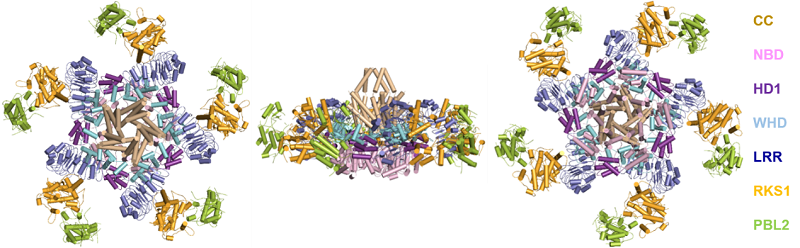
图2 植物抗病小体不同视角的结构示意图
两篇文章的研究成果是通过对抑制状态复合物的结构和功能解析,阐明了抗病蛋白由抑制状态,经过中间状态,最终形成抗病小体的生化过程,合作团队紧密结合结构、生化、和功能研究,揭示了抗病小体工作机制(图3)。比如,抗病小体形成后直接在细胞质膜上发出自杀指令,很可能是植物细胞死亡和免疫执行者。该项工作填补了人们25年来对抗病蛋白认知的巨大空白,为研究其它抗病蛋白提供了范本。
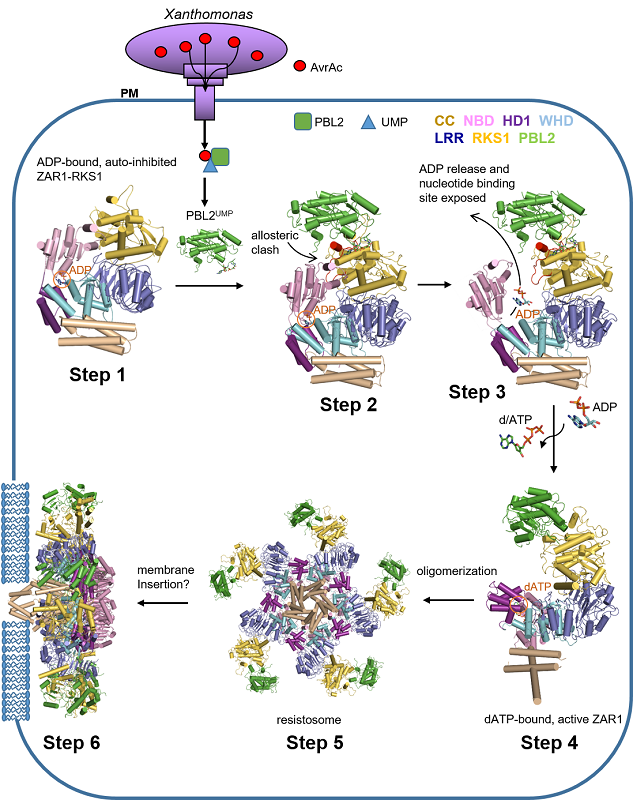
图3 植物抗病小体工作机制示意图
在Science杂志同期专文评述中,国际植物抗病研究权威科学家美国科学院院士Jeffery Dangl和英国皇家学会会员、美国科学院外籍院士Jonathan Jones对这一重大突破性成果给予高度评价:“首个抗病小体的发现,为植物如何控制细胞死亡和免疫提供了线索”(“The first plant resistosome structure provides clues to cell death control and immunity”),显著的推进了人们对植物免疫机制的认识(“These important findings substantially advance our understanding of plant immune mechanisms”), 打开了多个开拓性研究方向 (“open many new lines of what is sure to be ground-breaking research”)。《植物学报》同时发表国际著名植物抗病专家Xin Li(李昕)等人题为“开启防御之门:植物抗病小体”的专文评述,认为该项成果“完成了植物NLR蛋白复合物的组装、结构和功能分析,揭示了NLR作用的关键分子机制,是植物免疫研究的里程碑事件”。
各种农作物病虫害,严重威胁农业生产。为了减少损失,农业生产中不得不大量施用化学农药,但这又对环境、人类健康、和农业可持续发展带来了挑战。在保护作物的同时,减少化学农药的施用,成为摆在农业生产者和科学家面前的一道难题。解决这一问题的关键,就存在于植物细胞中:植物细胞内数目众多的抗病蛋白。这些蛋白发现病菌后,迅速启动植物防卫反应,杀死病菌,从而保护植物免受侵害。利用抗病蛋白,设计新型抗病虫育种,将大大减少化学农药的施用。抗病蛋白高分辨度结构和作用机制的解析,将为设计抗广谱、持久的新型抗病蛋白,发展绿色农业奠定了核心理论基础。
清华大学生命科学学院博士后王继纵、王家与中国科学院遗传与发育生物学研究所博士生胡梅娟为第一篇论文的共同第一作者;王继纵、胡梅娟和王家为第二篇论文的共同第一作者。柴继杰、周俭民与王宏伟为两篇论文的共同通讯作者。清华大学生命科学学院戚益军教授、韩志富副研究员和中国科学院遗传与发育生物学研究所博士生漆金凤、王国勋博士在两篇论文中参与了部分工作,原清华大学生命科学学院高宁研究员、吴姗博士在第一篇论文中参与了部分工作。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。本工作获得了国家自然科学基金委、科技部、北京市科委、清华-北大生命科学联合中心和北京市结构生物学高精尖创新中心等的大力支持。
背靠背Science文章
Wang JZ#, Wang J#, Hu M#, Wu S, Qi J, Wang G, Han Z, Qi Y, Gao N, Wang HW*, Zhou JM*, Chai J* (2019). Ligand-triggered allosteric ADP release primes a plant NLR complex. Science
Wang JZ#, Hu M#, Wang J#, Qi J, Han Z, Wang G, Qi Y, Wang HW*, Zhou JM*, Chai J* (2019). Reconstitution and structure of a plant NLR resistosome conferring immunity. Science
专文评述
夏石头 李昕(2019). 开启防御之门:植物抗病小体. 植物学报
Dangl J, Jones JDG (2019). a pentangular plant inflammasome. Science
原文链接:
http://science.sciencemag.org/content/364/6435/eaav5868
http://science.sciencemag.org/content/364/6435/eaav5870
http://science.sciencemag.org/content/364/6435/31
http://www.chinbullbotany.com/CN/1674-3466/home.shtml