清华大学生命科学学院颉伟课题组与郑州大学第一附属医院孙莹璞/徐家伟课题组合作,揭示了人类早期发育过程中组蛋白修饰的重编程过程。研究成果以“人类亲本-合子转变中组蛋白修饰的重编程”(Resetting histone modifications during human parental-to-zygotic transition)为题,以研究论文的形式于2019年07月04日在《科学》(Science)上在线发表。
表观遗传学修饰参与基因表达调控并影响个体发育。在哺乳动物早期胚胎发育过程中,卵细胞受精形成具有全能性的受精卵,并经过细胞分裂与分化形成囊胚,后者包含具有多能性的内细胞团。伴随着发育的进行,表观遗传学修饰经历了剧烈的重编程。近年来,以小鼠等模式生物为研究模型,DNA甲基化、染色质开放性、染色质高级结构以及组蛋白修饰等表观遗传学特征的动态变化过程和规律都逐渐被揭示。以组蛋白修饰为例,之前的研究发现,在小鼠卵细胞发育晚期,组蛋白修饰H3K4me3和H3K27me3会以非经典的形式分布,并能够通过母源继承的方式传递到胚胎中调控子代的基因表达和发育过程。干扰组蛋白修饰的重编程会造成小鼠发育的缺陷。这些研究表明,经典的表观修饰能在发育早期以非经典的形式存在并发挥独特的功能,并对哺乳动物发育至关重要。然而,由于人类卵细胞和早期胚胎样品的稀缺性,组蛋白修饰的重编程在人类早期胚胎发育过程中是否遵循和小鼠相似的重编程规律、这些重编程对于人类胚胎发育的有怎样的生物学意义还知之甚少。此外,人类早期胚胎发育的研究对于辅助生殖等临床应用也有重要的指导意义。
颉伟实验室利用并优化了蛋白与染色质结合位点检测的新技术CUT&RUN,成功地在少至50细胞的样品中实现了组蛋白修饰全基因分布的检测。研究团队进一步与孙莹璞/徐家伟课题组合作,在人类发育成熟的卵母细胞和早期胚胎中检测了H3K4me3,H3K27me3以及H3K27ac的动态变化。研究结果表明,人类早期胚胎发育过程中的组蛋白重编程经历了和小鼠非常不同的动态变化。前期研究表明,在小鼠中,H3K4me3与H3K27me3均呈现与体细胞不同的非经典的分布规律。而在人类卵细胞中,H3K4me3与H3K27me3均呈现经典的分布模式。在受精后,小鼠中母源H3K27me3能够传递至囊胚,而人类的H3K27me3在合子基因组激活前被大规模地去除,并在基因组激活后重新建立。H3K4me3在合子基因组激活前出现在许多启动子区域以及基因远端开放区域,并伴随着这些区域染色质开放性的建立。研究团队将这种H3K4me3称之为预备性的H3K4me3(priming H3K4me3)状态。在合子基因组激活后,这些区域会转变为激活或抑制的状态。研究人员提出了“表观基因组重启”模型(图)。这些结果说明人类早期发育中的组蛋白重编程具有高度的物种特异性。研究团队也研究了人类早期谱系分化过程的表观遗传学调控。通过结合染色质图谱和已发表的单细胞转录数据,研究团队预测了人类早期谱系的关键调控因子。有趣的是,研究团队发现在人类早期胚胎中,相比较滋养外胚层的特异基因,内细胞团(包括上胚层和原始内胚层)的特异基因会更多的被H3K27me3所标记。这说明不同谱系的特异基因在早期发育分化过程中会被抑制性表观修饰不对称标记。综上所述,这些结果揭示了人类早期发育中组蛋白修饰重编程的特殊性以及研究人类早期胚胎发育的重要性。同时,这些结果也为未来进一步理解人类早期胚胎的发育和临床指导提供了关键的数据和线索。
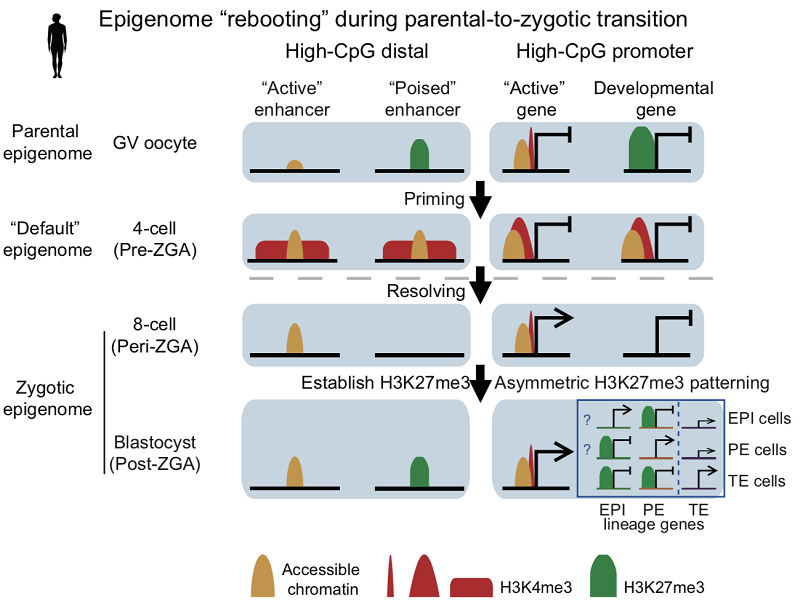
图. 人类早期发育过程中组蛋白修饰的重编程模式
郑州大学第一附属医院孙莹璞、清华大学生命科学学院颉伟以及郑州大学第一附属医院徐家伟为本文通讯作者,夏炜焜(清华大学生命科学CLS博士生)、徐家伟(郑州大学第一附属医院)、于广(清华大学生科院博士生)、姚桂东(郑州大学第一附属医院)为本文共同第一作者。北京大学前沿交叉学科研究院博士生许锴、郑州大学第一附属医院医生马雪山和博士生张楠也在该课题中做出了重要贡献。合作实验室还包括清华大学那洁课题组。该课题得到了清华大学实验动物中心、生物医学测试中心基因测序平台以及计算平台,以及河南省妇产疾病(生殖医学)临床研究中心的大力协助和支持。该研究获得了国家科技部重点研发计划、国家重点基础研究发展计划(973计划)、国家自然科学基金委优秀青年基金、国家自然科学基金委杰出青年基金、北京市科委生命科学前沿培育项目,生命科学联合中心以及美国霍华德休斯医学研究所国际研究学者(HHMI International Research Scholar)的经费支持。
论文链接:https://science.sciencemag.org/content/early/2019/07/02/science.aaw5118