2019年9月 5日,清华大学生命科学学院钟毅课题组在《美国科学院院刊》(PNAS)在线发表了题为“果蝇不稳定记忆和稳定记忆主动遗忘的遗传解析”(Genetic Dissection of Active Forgetting in Labile and Consolidated Memories in Drosophila)的研究论文。该论文首次对果蝇不稳定短记忆和稳定长记忆主动遗忘的下游分子机制进行了系统地比较和解析,发现不稳定短记忆的主动遗忘由Rac1/WAVE complex/ Dia通路介导,而稳定长记忆的主动遗忘通过Cdc42/WASp/ Arp2/3 complex通路介导。由于Dia和Arp2/3 complex被报道分别调控神经元微丝骨架线性生长和分支生长,这使得本论文研究成果提供了一个有趣的可能性:稳定性不同的记忆组分的主动遗忘可能与神经元不同形式的微丝结构的生长方式有关。
早在1885年,德国心理学家艾宾浩斯(Hermann Ebbinghaus)就描绘出了人类大脑对于新习得记忆的遗忘曲线,从此开始了人类探寻遗忘奥秘的旅程。在随后的一百多年间,许多学者利用实验心理学的方法,试图寻找遗忘的产生机制,也随之创造了多种理论去解释遗忘现象,但最终都未能获得统一答案。遗忘现象作为人类记忆的基本特征,虽然在心理学中被广泛地研究和报道,但是在神经生物学的研究中几乎无人问津,俨然成为了被“遗忘”的角落。主要原因可能是遗忘过程被简单地认为是记忆失败的另外一种描述方式,是一个被动的过程(记得差则忘得快,记得好则忘得慢),从而忽略了遗忘自身可能存在独特的分子机制。
直到2010年,钟毅教授课题组首次发现了主动遗忘的生物机制,即学习过程本身会激活遗忘信号分子通路来主动地遗忘所形成的记忆(Shuai et al., 2010, Cell)。这种主动遗忘机制并不影响学习自身效果的好坏,而是特异影响已获得记忆遗忘速度的快慢。而且不同记忆组分会分别拥有专属的主动遗忘机制。如在果蝇嗅觉惩罚学习中,一次训练(5分钟)即可同时产生两种性质完全不同的记忆组分:不稳定的、维持几个小时的麻醉敏感记忆(ASM, anesthesia-sensitive memory)和较为稳定的、维持一天以上的抗麻醉记忆(ARM, anesthesia-resistant memory)。钟毅课题组先后发现一次学习会一方面激活小G蛋白家族中的Rac1分子来抹掉不稳定的、维持几个小时的麻醉敏感记忆(Shuai, et al., 2010, Cell),另一方面激活另一个小G蛋白家族成员Cdc42分子来遗忘较为稳定的、维持一天以上的抗麻醉记忆(Zhang, et al., 2016, Cell Reports)。然而Rac1与Cdc42分别介导的遗忘机制的具体下游分子通路并不清楚。近日钟毅课题组在线发表的研究论文首次解析了这两种遗忘机制的下游分子通路:Rac1/WAVE complex/ Dia通路介导短记忆组分(不稳定的、维持几个小时的麻醉敏感记忆)的主动遗忘,而Cdc42/WASp/ Arp2/3 complex通路介导长记忆组分(较为稳定的、维持一天以上的抗麻醉记忆)的主动遗忘。这两种主动遗忘机制均发生在果蝇学习记忆中枢蘑菇体中(蘑菇体约包含4000个神经元,整个果蝇大脑有10万以上的神经元)。有趣的是,细胞生物学研究发现Dia直接负责微丝骨架的线性生长,而Arp2/3 complex则负责微丝骨架的分支生长。这提示我们不同记忆组分的主动遗忘功能可能与神经元的微丝骨架结构的不同形式的动态变化相关。这些研究成果一方面将我们对遗忘分子机制的理解带入了更加精细的维度,另一方面为直接调控遗忘功能提供了更多有效的药理学靶点。
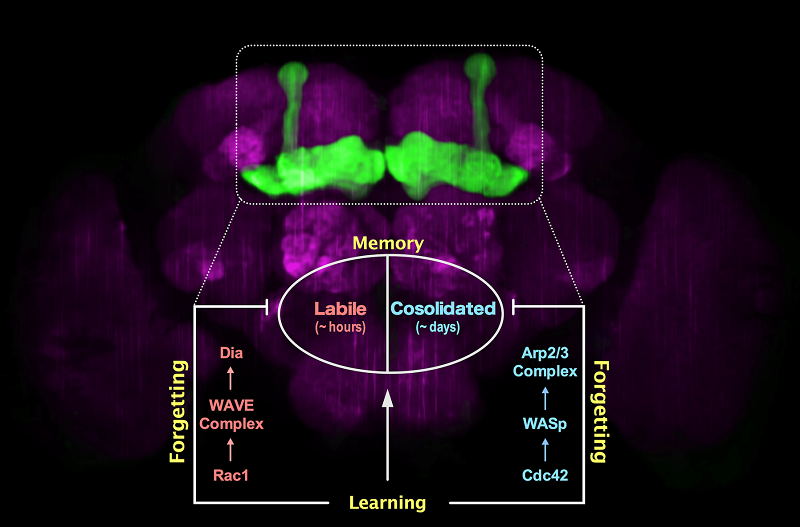
图1. 稳定记忆和不稳定记忆的遗忘机制解析
清华大学生命科学学院博士生高扬、美国Janelia Research Campus的研究专员帅祎春、清华大学生命科学学院已毕业博士生张煦晨和博士生彭榆玮为本文共同第一作者。王连章老师、贺敬博士参与本文研究。清华大学钟毅教授和李乾助理研究员为本文共同通讯作者。本研究感谢Jennifer A. Zallen博士、 Ronald L. Davis博士、Ulrike Heberlein博士、Gerry Rubin博士和André Fiala博士赠送的果蝇品系,感谢欧光朔研究员、梁鑫研究员、胡皖桐博士、张云川博士、赵博涵和雷博提供的帮助和建议,感谢国家自然科学基金、北京市科委和清华-北大生命联合中心的资助。