个人简介
白 蕊
性别:女
年级:2015级直博
导师:施一公教授
专业方向:结构生物学
爱好:素描
最喜欢的一句话:要有最朴素的生活与最遥远的梦想。
学术成果
迄今已经发表高水平科研论文7篇,其中5篇发表于美国《科学》期刊(影响因子:41.058),2篇发表于美国《细胞》期刊(影响因子:31.398),其中以共同第一作者身份发表文章6篇,2篇排位第一,引用次数累计373次。
所获荣誉
2015年清华大学“未来学者”奖学金
2016年清华大学综合优秀奖学金(陶氏化学奖)一等奖
2017年研究生国家奖学金
2017年清华大学高精尖创新中心创新博士生奖学金优秀奖
2018年第23届清华大学“学术新秀”提名奖
2018年研究生国家奖学金
2018年清华大学特等奖学金(研究生)
RNA剪接体的研究之路
白蕊,本科毕业于武汉大学生命科学学院生物学基地班。2015年9月,她凭借专业排名第一的优异成绩,被保送到清华大学生命科学学院,师从施一公教授。在博士入学之前,她来到施一公教授实验室开展毕业设计。初来乍到,她被施老师实验室高速、高效的工作模式所震撼,在这样的环境里学习,既激动又倍感压力。但压力即是动力,凭借自己扎实的基础知识以及不懈的努力,她在专业知识和实验技能上快速地成长。不到半年,不仅完全适应了实验室的工作模式,而且还成为了课题组的骨干成员,从此踏上了研究剪接体结构与机理的征途。

白蕊本科毕业照
RNA剪接体是何物?
RNA剪接是真核生物遗传信息传递过程中涉及中心法则的关键一环,通过RNA剪接,真核生物基因通过转录所得到的前体信使RNA(pre-mRNA)分子中的内含子被去除、外显子相连,从而形成蛋白质的翻译模板——成熟信使RNA(mature mRNA)。RNA剪接普遍存在于真核生物中,随着物种的进化,含有内含子的基因数量增加,发生RNA剪接的频率也相应增高,使得一个基因编码多个蛋白质成为可能,极大的丰富了真核生物蛋白质的多样性。
RNA剪接的本质是两步转酯反应,这种看似简单的化学反应在细胞中难以自行发生,而是需要一个巨大且高度动态变化的分子机器——剪接体(spliceosome)来完成。剪接体是一个由上百种蛋白质因子介导、核酸(RNA)催化的金属核酶,在剪接反应过程中,剪接体亚复合物及蛋白因子按照高度精确的顺序结合和解聚,依次形成预组装复合物 U4/U6.U5 tri-snRNP 及至少8个状态的完全组装剪接体 pre-B、B、Bact、B*、C、C*、P和ILS复合物,从而完成RNA剪接反应。
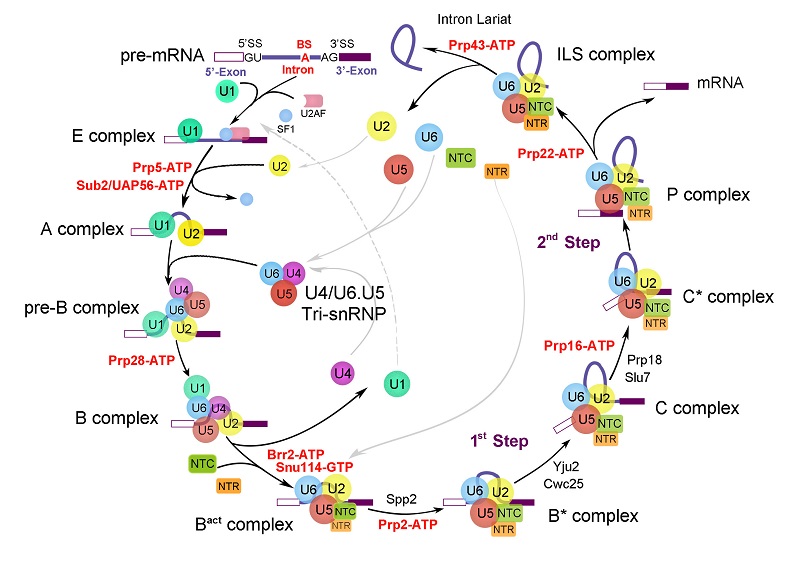
RNA剪接体工作原理
由此可见,剪接体构象多变、组成极其复杂。研究表明,30%的人类遗传紊乱以及多种癌症均与某些基因的错误剪接、剪接体蛋白组分的突变以及剪接体的错误调控有关。然而,剪接体催化过程中不同构象高分辨率结构的缺失严重限制了我们对剪接体工作机制以及RNA剪接的分子机理的理解。因此,对于剪接体以及RNA剪接通路上各复合物结构的研究,是真核生物生命活动最基础的研究工作之一,也是当今世界最富有挑战性、最亟待解决的课题之一,对理解剪接体相关疾病的发病机理以及发展针对这些疾病的治疗方案具有显著的影响与指导意义,而对不同反应阶段的剪接体进行结构解析是研究其机理并指导疾病治疗方案的核心与关键。
迎难而上
当时,国际上还从未有人成功解析过以上不同状态剪接体的高分辨率三维结构。在施老师的鼓励与指点下,白蕊开始研究攻克更为关键的不同功能状态下的剪接体结构机制。在这个过程中,她仔细研读了大量的文献,分析了不同状态剪接体中的特有蛋白,凭借对课题的深入理解与扎实的实验基础,她所在的团队成功分离出4个状态的剪接体,同时她以共同一作的身份在生命科学领域顶级期刊《科学》和《细胞》上发表了共4篇重大成果。其中两篇在《科学》期刊上以“背靠背”的形式发表,在领域内掀起了极大的轰动。白蕊回忆这段经历时说道:“这段时期的实验训练与对课题的深入理解,让我的逻辑思维与科学素养日渐成熟,逐渐显露出敏锐的逻辑思维。”
在研究中白蕊意识到,从细胞内源直接提取的剪接体多是构象相对稳定的状态,而剪接体的瞬变(transient)状态对理解RNA剪接的分子机制更为重要,所以她决定转向研究瞬变状态的剪接体结构。但是,这方面的工作少有文献报道,因为处于瞬变状态的剪接体丰度极低,也很不稳定,无法直接从细胞中分离出来。这一问题,被结构生物学领域内的同行们认为是全面解析剪接体功能的一大瓶颈。当时的白蕊,已经成为可以独当一面的group leader,自信、勇敢的她决定迎难而上!作为核心与骨干力量,她决心带领课题组攻克难关!
为了获得瞬时状态的剪接体样品,白蕊曾彻夜难眠,起初不知如何入手。两个月内她阅读了大量的文献,突然发现可以通过在细胞内改造某些RNA剪接过程中的关键蛋白,使得剪接体在细胞内被阻隔在某些特定状态,来突破剪接体领域的瓶颈。当时的她欣喜若狂,迫不及待地开展实验,一刻也不想停下。然而,新的问题来了——在细胞内过表达这些关键蛋白的失活体,细胞不能正常生长了!
办法总比困难多,不向困难服输的白蕊又开始日以继夜、夜以继日地进行优化,寻找既不会影响细胞生长又能将剪接体阻碍在某种瞬变状态的关键蛋白失活体。经过了多次实验,她终于找到了最佳的实验方案,解决了细胞不能正常生长的问题。这使得她一击即中,首次成功解析了世界上被认为难以捕捉的瞬变状态剪接体post-catalytic spliceosome(催化后剪接体),并以第一作者的身份在美国《细胞》杂志上发表了该重大成果。这项发现在领域内引起了不小的轰动,并为该领域长达数年的猜想与争论提供了最有效的证据。

白蕊实验照
新的挑战
运用自己优化的最佳实验方案获得成功之后,白蕊举一反三,立刻投入到RNA剪接中一个全新的瞬变状态——pre-B complex的捕获中。在此之前,世界上从未有课题组捕获并解析过该状态的剪接体。Pre-B complex具有更高度的动态性,挑战更大。仅仅使用之前的优化方案并不成功,这提示她需要再寻找更好的实验方案。作为课题的负责人,白蕊创新性地改变了以往的提纯方法,更重要的是,根据该复合物的特点,她敏锐地意识到并更换了实验步骤中的一些试剂,因此大大提高了样品的稳定性。这些关键细节的改变,使得她和她带领的团队首次解析了世界上最大、最复杂、最难获得稳定样品的pre-B complex近原子分辨率的三维结构,该重大成果发表在美国《科学》杂志上。文章发表后,领域内的科学家们惊叹这个庞大且高度动态的剪接体的结构之精美,许多学者纷纷写信表示祝贺并询问细节,审稿人更是将该结构评价为史上最重要、最振奋人心的剪接体结构之一。
当被问到为何能在三年时间内做出这么多漂亮的工作时,白蕊回答道:“能取得这样的成绩,首先我要感谢导师施一公教授对我的指导、帮助与信任。其次,感谢团队的成员,团队的共同努力往往起到一加一大于二的效果。最后,就我个人而言,我认为对课题的深层次理解、对课题的全身心投入,以及对待实验须有的严谨态度与操作,都是快速推进课题的重要因素。不放过实验中的每一个细节,就会离成功更近一点。”
“曾经的荣耀已然过去,对RNA剪接分子机理的研究却没有终点。我将继续带领团队乘风破浪,在研究RNA剪接分子机理的道路上勇往直前!”白蕊对未来的科研生涯充满信心地说道。
已发表论文:
[1] Bai R , Wan R , Yan C , et al. Structures of the fully assembled\r, Saccharomyces cerevisiae\r, spliceosome before activation[J]. Science, 2018:eaau0325.
[2] Bai R , Yan C , Wan R , et al. Structure of the Post-catalytic Spliceosome from Saccharomyces cerevisiae[J]. Cell, 2017, 171(7):págs. 1589-1598.
[3] Wan R , Yan C , Bai R , et al. Structure of an Intron Lariat Spliceosome from, Saccharomyces cerevisiae[J]. Cell, 2017:S0092867417309546.
[4] Yan C , Wan R , Bai R , et al. Structure of a yeast step II catalytically activated spliceosome[J]. Science, 2017, 355(6321):149-155.
[5] Yan C , Wan R , Bai R , et al. [Research Article] Structure of a yeast activated spliceosome at 3.5 A resolution[J]. Science, 2016, 353(6302):904-911.
[6] Wan R , Yan C , Bai R , et al. Structure of a yeast catalytic step I spliceosome at 3.4 A resolution[J]. Science, 2016, 353(6302):895-904.
[7] Wan R , Yan C , Bai R , et al. The 3.8 A structure of the U4/U6.U5 tri-snRNP: Insights into spliceosome assembly and catalysis[J]. Science, 2016, 351(6272):466-475.